
Процесс распада электролита на ионы, известный также как ионизация, является одним из основных явлений химических реакций. Электролиты — это вещества, способные проводить электрический ток в растворенном состоянии. При контакте с растворителем или при плавлении электролиты начинают распадаться на положительно и отрицательно заряженные частицы — ионы.
Распад электролита на ионы происходит под действием растворяющего агента или приложенного электрического поля. Ионы, образованные в результате этого процесса, обладают свойствами ионов за счет наличия электрического заряда. Они способны перемещаться в растворе или проводить электрический ток в электролите. Таким образом, ионизация электролита играет важную роль во многих физико-химических процессах, таких как электролиз, электрохимическая реакция, растворение веществ и многие другие.
Процесс ионизации изучается в различных областях науки, включая химию, физику и биологию. Он имеет широкое применение в различных отраслях промышленности, нанотехнологий и медицины. Понимание механизма ионизации электролитов позволяет контролировать химические и физические процессы, создавать новые материалы и технологии, а также исследовать множество явлений в природе.
Электролиты: что это?
Электролитами называют вещества, способные в растворе или плавленом состоянии разделяться на положительно и отрицательно заряженные ионы. Этот процесс называется распадом электролита.
Ионы могут быть положительно заряженными (катионами) или отрицательно заряженными (анионами). Положительно заряженными ионами могут быть металлы или ионы металла в соединении. Отрицательно заряженными ионами могут быть неметаллы или ионы неметалла в соединении.
Электролиты играют важную роль в различных процессах в организме, таких как передача нервных импульсов, сокращение мышц, управление уровнем воды и рН в теле.
Кроме того, электролиты широко используются в различных отраслях промышленности, например, в электрохимических процессах, батареях, аккумуляторах, электролитической обработке металлов и многих других областях.
Важно отметить, что распад электролита на ионы происходит только в растворах или плавленом состоянии, в твердом состоянии электролиты не проводят электрический ток. Это связано с тем, что ионы могут свободно двигаться и образовывать электрический потенциал только в плавленом или растворенном виде.
Что такое ионы и почему они образуются?
Образование ионов происходит благодаря потере или приобретению электронов. Атомы с одним или несколькими свободными электронами могут стать положительными ионами, или катионами, если они потеряют электрон(ы). Атомы, которым необходимо приобрести электрон(ы), чтобы достичь стабильной конфигурации, становятся отрицательными ионами, или анионами.
Процесс ионизации
Процесс ионизации можно наблюдать в электролитах, таких как соли или кислоты, когда они растворяются в воде или плавятся. В результате этого процесса, электролит разделяется на положительно заряженные ионы или катионы и отрицательно заряженные ионы или анионы.
Ионизация осуществляется путем взаимодействия между электролитом и водой. Вода, являясь полярным растворителем, разделяет молекулы электролита на ионы. Положительно заряженные частицы притягиваются к отрицательно заряженным кислородам воды и образуют катионы, а отрицательно заряженные частицы притягиваются к положительно заряженным водородам воды и образуют анионы.
Примеры ионов
Примерами катионов могут служить ионы натрия (Na+), калия (K+), кальция (Ca2+) и магния (Mg2+). Анионы могут быть представлены ионами хлорида (Cl-), гидроксида (OH-), сульфата (SO42-) и нитрата (NO3-).
| Ион | Заряд |
|---|---|
| Натрий (Na+) | + |
| Хлорид (Cl-) | — |
| Калий (K+) | + |
| Гидроксид (OH-) | — |
| Кальций (Ca2+) | 2+ |
| Сульфат (SO42-) | 2- |
| Магний (Mg2+) | 2+ |
| Нитрат (NO3-) | — |
Ионы играют важную роль в многих химических реакциях, электролитических и гальванических процессах, а также в проводимости электричества в растворах и водных средах.
Процесс электролиза: как происходит распад электролита на ионы?
Процесс электролиза осуществляется в электролитической ячейке, состоящей из двух электродов – анода и катода. Анод – положительно заряженный электрод, на котором происходит окисление вещества. Катод – отрицательно заряженный электрод, на котором происходит восстановление вещества.
В начале электролиза между электродами образуется электрохимическая система. Электрический ток, пропущенный через электролитическую ячейку, вызывает движение электронов. При этом положительно заряженные ионы электролита (катионы) перемещаются к отрицательно заряженному катоду, а отрицательно заряженные ионы электролита (анионы) перемещаются к положительно заряженному аноду.
На аноде происходит окисление вещества, сопровождающееся потерей электронов. При этом катионы готовятся к принятию электронов и превращаются в нейтральные атомы или молекулы. На катоде происходит восстановление вещества, сопровождающееся приобретением электронов. Анионы принимают электроны и превращаются в нейтральные атомы или молекулы.
Процесс электролиза является важным в химической промышленности. Он позволяет получать различные элементы, соединения и вещества. Кроме того, электролиз используется для очистки воды, производства металлов, производства электричества и других целей.
Виды электролитов: на что нужно обратить внимание?
Первым типом электролитов являются сильные электролиты. Они полностью распадаются на ионы в водном растворе. Сильные электролиты могут быть как неорганическими (например, NaCl, HCl), так и органическими (например, уксусная кислота).
Второй тип электролитов — слабые электролиты. Они лишь частично распадаются на ионы в растворе. Примерами слабых электролитов могут служить угольная кислота (H2CO3) или аммоний (NH4+).
Третий тип электролитов — неметаллические электролиты. Они обладают способностью проводить электрический ток при наличии влаги или при повышенной температуре. Примерами неметаллических электролитов являются газы, такие как водород (H2) и кислород (О2).
Наконец, четвертый тип электролитов — органические электролиты. Они содержат в своей структуре органические соединения и способны проводить электрический ток. Органические электролиты используются в различных областях, включая медицину, фармакологию и промышленность.
При работе с электролитами необходимо обратить внимание на их тип, силу и иные свойства, поскольку они могут существенно влиять на результаты химических и физических процессов.
Факторы, влияющие на скорость распада электролита на ионы
Скорость распада электролита на ионы может быть подвержена влиянию различных факторов, которые определяют интенсивность процесса. Эти факторы включают в себя:
- Концентрация электролита. Чем выше концентрация электролита, тем больше ионов будет присутствовать в растворе, что способствует более быстрому распаду электролита на ионы.
- Температура раствора. Увеличение температуры приводит к увеличению скорости распада электролита на ионы, так как молекулы движутся быстрее и сталкиваются друг с другом с большей энергией.
- Поверхность контакта. При большей поверхности контакта между электролитом и растворителем происходит более интенсивный обмен ионами.
- Давление. Давление влияет на распределение молекулярного течения, что в свою очередь может отразиться на скорости распада электролита на ионы.
- Посторонние вещества. Наличие других веществ в растворе может повлиять на скорость распада электролита на ионы, так как они могут участвовать в реакции или взаимодействовать с ионами формирующегося раствора.
Понимание этих факторов позволяет контролировать и регулировать скорость распада электролита на ионы, что имеет важное практическое значение в различных областях науки и техники.
Ионная мобильность: почему некоторые ионы движутся быстрее других?
Одной из главных причин различий в ионной мобильности является размер иона. Ионы, которые имеют меньший размер, обычно двигаются быстрее. Это связано с тем, что меньшие ионы легче преодолевают силы взаимодействия с растворителем и другими ионами.
Также важную роль играет заряд иона. Ионы с большим зарядом могут обладать большей мобильностью по сравнению с ионами с меньшим зарядом. Это связано с тем, что ионы с большим зарядом создают более сильное электрическое поле вокруг себя и могут эффективнее перемещаться под его воздействием.
Еще одним фактором, влияющим на ионную мобильность, является вязкость растворителя. Вязкие растворители могут замедлить движение ионов и снизить их мобильность, в то время как менее вязкие растворители способствуют более быстрому перемещению ионов.
Наконец, концентрация ионов в растворе также может влиять на ионную мобильность. Повышение концентрации ионов может привести к увеличению сил взаимодействия между ионами, что может замедлить их движение.
Таким образом, ионная мобильность зависит от нескольких факторов, включая размер иона, его заряд, вязкость растворителя и концентрацию ионов. Понимание этих факторов позволяет объяснить, почему некоторые ионы движутся быстрее других в растворах электролитов.
Ионизация электролита: что это такое и как она происходит?
Ионизация происходит в случае, когда электролит растворяется в воде или другом растворителе, образуя положительные и отрицательные ионы. Это явление связано с удержанием отдельных атомов или групп атомов в растворе в свободной форме или в виде ионов.
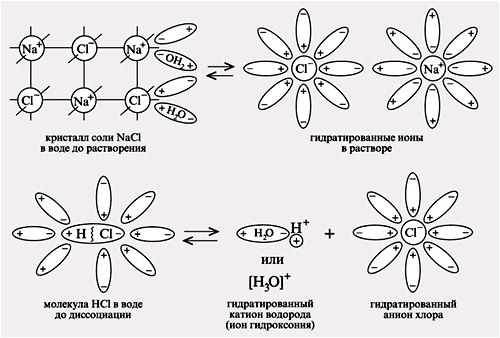
В процессе ионизации, молекулы электролита разделяются на положительно и отрицательно заряженные ионы. Например, соль NaCl ионизуется в водном растворе на положительно заряженный ион натрия (Na+) и отрицательно заряженный ион хлорида (Cl-).
Ионизацию электролитов можно также осуществить с помощью электрического поля, приложенного к раствору электролита. При этом, положительные ионы перемещаются к отрицательному электроду (аноду), а отрицательные ионы перемещаются к положительному электроду (катоду).
Ионизация электролита является основополагающим процессом для многих химических реакций и явлений. Она позволяет электролитам проявлять такие свойства, как проводимость электрического тока и возможность участия в химических реакциях. Именно благодаря ионизации электролиты могут выполнять важные функции в организме живых существ, в промышленности и в различных областях науки.
Практическое применение процесса распада электролита на ионы
Процесс распада электролита на ионы имеет широкое практическое применение в различных областях науки и техники. Следует отметить несколько основных сфер, в которых этот процесс находит применение:
1. Электролитическое получение веществ
Ионы, получаемые при распаде электролита, могут использоваться для электролитического получения различных веществ. Например, электролизом раствора хлорида натрия можно получить хлор, кислород и гидроксид натрия. Также этот процесс применяется для получения металлов, например, алюминия и цинка.
2. Аккумуляторы
Процесс распада электролита на ионы играет важную роль в работе различных типов аккумуляторов. Аккумуляторы используются для хранения энергии и последующего ее высвобождения. Когда аккумулятор разряжается, ионы переносятся из одного электрода в другой, образуя заряд и создавая электрический ток.
3. Электрохимические процессы
Процессы электролиза, которые основаны на распаде электролита на ионы, используются в различных электрохимических процессах. Например, они применяются для очистки воды, удаления загрязнителей и получения нужных веществ. Кроме того, электрохимические процессы с участием ионов электролитов применяются в производстве металлов и синтезе органических соединений.
Таким образом, процесс распада электролита на ионы является важным и широкоиспользуемым явлением, имеющим множество практических применений в различных областях науки и техники.
Вопрос-ответ:
Что такое процесс распада электролита на ионы?
Процесс распада электролита на ионы называется ионизацией. В химии ионизация – это процесс образования ионов, в результате которого нейтральные атомы или молекулы приобретают электрический заряд.
Как происходит процесс ионизации электролита?
Процесс ионизации электролита происходит при растворении в воде или плавлении электролитического соединения. При этом, положительные ионы – катионы и отрицательные ионы – анионы, образуются из ионообразующихся частиц электролита.
Какие условия необходимы для распада электролита на ионы?
Для распада электролита на ионы необходимо наличие вещества, которое может образовывать ионы в растворе или плавиться, а также наличие среды, способствующей ионизации вещества, как, например, вода.
Какие типы электролитов существуют?
Существуют два типа электролитов: кислотные электролиты, распадающиеся на катионы водорода (H+) и анионы, образующиеся из кислоты, и щелочны и соли, распадающиеся на катионы металлов и противоположно заряженные анионы.