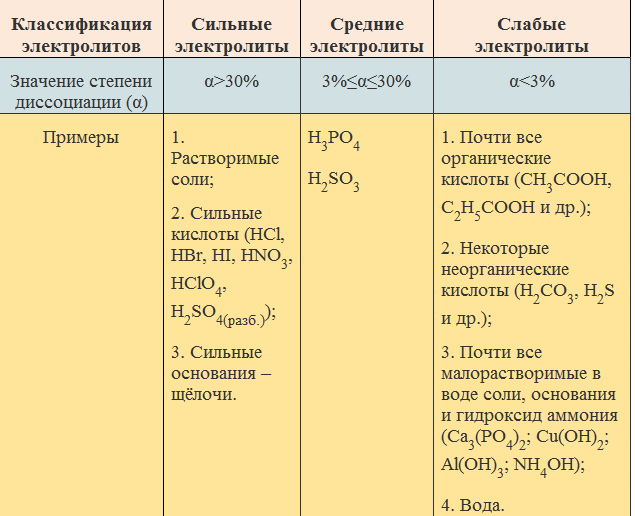
В химии электролиты являются важной частью изучения различных веществ. Они могут быть кислотами, основаниями или солями. Классификация электролитов помогает понять их свойства и использование в химических реакциях.
Кислоты — это электролиты, которые способны отдавать протоны (H+) в растворе. Они могут быть органическими (например, уксусная кислота) или неорганическими (например, серная кислота). Кислоты обычно имеют кислотный вкус, реагируют с металлами, образуя соли, и изменяют цвет индикаторов.
Основания, с другой стороны, являются электролитами, которые способны принимать протоны (H+) из раствора. Они могут быть сильными (например, натриевая гидроксидная щелочь) или слабыми (например, аммиак). Основания обычно имеют горький вкус, щелочной свойства и изменяют цвет индикаторов.
Примеры кислот включают серную, уксусную и соляную кислоту, а также аскорбиновую кислоту. Примеры оснований включают натрий, калий и аммиак. Эти примеры позволяют лучше понять разнообразие электролитов и их важность в химических процессах.
Классификация электролитов
1. Кислоты
Кислоты — это соединения, которые в растворе отдают водным растворителям (воде) положительные ионы водорода (H+). Примеры кислот: соляная кислота (HCl), серная кислота (H2SO4), уксусная кислота (CH3COOH).
2. Основания
Основания — это соединения, которые в растворе отдают водным растворителям (воде) отрицательные ионы гидроксида (OH-). Примеры оснований: гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид аммония (NH4OH).
3. Соли
Соли — это соединения, которые в растворе образуют ионы, отличные от водорода (H+) и гидроксида (OH-). Ионы, которые образуют соли, могут быть положительными (катионами) или отрицательными (анионами). Примеры солей: хлорид натрия (NaCl), сульфат меди (CuSO4), нитрат калия (KNO3).
4. Несколько типов электролитов
Есть и другие типы электролитов, такие как кватернионные соли (имеют четыре ионых заряда), амины (содержат функциональную группу амина) и др. Классификация электролитов может быть уточнена в зависимости от ионов, которые они образуют в растворе.
Важно отметить, что электролитами могут быть не только вещества в растворе, но и реакционные промежуточные стадии в электролизе или при металлическом натрии.
Кислоты
Органические кислоты представляют собой соединения, содержащие одну или более карбоксильных групп (COOH). Они могут быть естественного происхождения, такие как уксусная кислота (CH3COOH) или яблочная кислота (C4H6O6), либо синтетического происхождения, например, ацетилсалициловая кислота (C9H8O4), известная как аспирин.
Неорганические кислоты — это соединения, которые не содержат карбоксильных групп. Наиболее распространенные неорганические кислоты включают серную кислоту (H2SO4), соляную кислоту (HCl) и азотную кислоту (HNO3). Эти кислоты активно используются в различных областях, включая производство удобрений, очистку воды и производство химических продуктов.
Основания
Основания могут классифицироваться по различным критериям, включая реакции, которые они вступают с кислотами. Некоторые из наиболее распространенных классификаций оснований включают:
- Оксидные основания: образуются при реакции оксидов с водой;
- Гидроксидные основания: образуются при реакции металлов или неметаллов с водой;
- Аммиачные основания: образуются при реакции аммиака или его производных со водой;
- Основания солей: образуются при реакции солей с водой.
Примеры оснований включают гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид кальция (Ca(OH)2) и аммиак (NH3).
Примеры электролитов
Примеры кислот:
- Соляная кислота (HCl) — при растворении она образует водные растворы, содержащие ионы водорода (H+) и хлорида (Cl-).
- Серная кислота (H2SO4) — при растворении она образует водные растворы, содержащие ионы водорода (H+) и сульфата (SO42-).
- Уксусная кислота (CH3COOH) — при растворении она образует водные растворы, содержащие ионы водорода (H+) и ацетата (CH3COO-).
Примеры оснований:
- Гидроксид натрия (NaOH) — при растворении он образует водные растворы, содержащие ионы натрия (Na+) и гидроксида (OH-).
- Гидроксид калия (KOH) — при растворении он образует водные растворы, содержащие ионы калия (K+) и гидроксида (OH-).
- Гидроксид аммония (NH4OH) — при растворении он образует водные растворы, содержащие ионы аммония (NH4+) и гидроксида (OH-).
Эти примеры являются типичными представителями электролитов и демонстрируют ионное поведение данных веществ при растворении.
Примеры кислот
Уксусная кислота — это кислота, которая образуется в результате сбраживания этилового спирта, и является одним из основных жизненно важных продуктов.
Соляная кислота — это очень сильная кислота, которая широко используется в химической промышленности для производства различных химических соединений.
Азотная кислота — это кислота, которая является одним из важных компонентов для производства удобрений и взрывчатых веществ.
Фосфорная кислота — это кислота, которая используется в производстве удобрений, стекла, моющих средств и других химических продуктов.
Примеры оснований
1. Гидроксид натрия (NaOH)
Гидроксид натрия, также известный как каустическая сода, является одним из наиболее распространенных оснований. Он широко используется в промышленности и бытовых целях. Гидроксид натрия обычно продается в виде твердых белых гранул или хлопьев.
2. Гидроксид калия (KOH)
Гидроксид калия, или каустическая еда, также является сильным основанием. Он используется в разных отраслях, включая производство мыла и удобрений, а также в лабораторных условиях.
3. Гидроксид аммония (NH4OH)
Гидроксид аммония, иногда называемый аммиачной солью или аммиачным гидроксидом, также является основанием. Он образуется при растворении аммиака в воде и используется в производстве удобрений и чистящих средств.
4. Гидроксид кальция (Ca(OH)2)
Гидроксид кальция, также известный как плотниковая известь или пожарная известь, является основанием, которое широко используется в строительстве и сельском хозяйстве.
5. Гидроксид магния (Mg(OH)2)
Гидроксид магния, также известный как молочная известь или магниевая молочка, является еще одним примером основания. Он используется в качестве противозапорной добавки в строительстве и имеет некоторые медицинские применения.
Обратите внимание, что эти примеры представляют только небольшую часть множества возможных оснований, которые могут существовать.
Вопрос-ответ:
Как классифицируются электролиты?
Электролиты классифицируются на основание и кислоты.
Что такое кислота?
Кислота — это вещества, которые в водном растворе образуют положительные ионы водорода (H+) и отрицательные ионы.
Что такое основание?
Основание — это вещество, которое в растворе образует отрицательные ионы гидроксида (OH-) и сопутствующие положительные ионы.
Можешь привести примеры кислот?
К примерам кислот относятся соляная кислота (HCl), уксусная кислота (CH3COOH), серная кислота (H2SO4) и многие другие.
А какие примеры можно привести для оснований?
Примерами оснований являются гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид аммония (NH4OH) и многие другие.
Какие основные типы электролитов существуют?
Основные типы электролитов: кислоты, основания и соли.