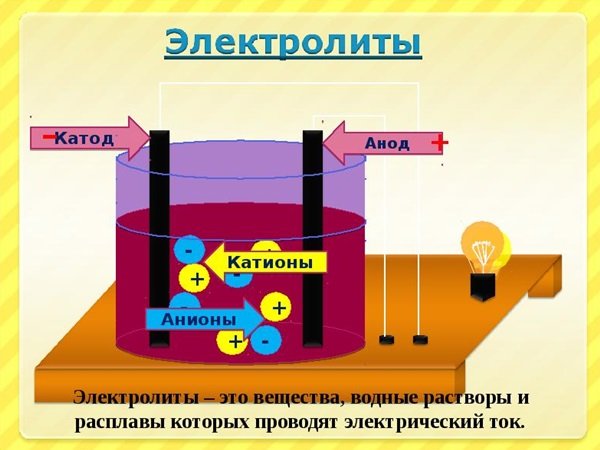
Электролиты — это вещества, способные в растворенном состоянии проводить электрический ток. Токопроводимость таких растворов объясняется наличием положительно и отрицательно заряженных частиц — ионов. Когда электролит растворяется, его молекулы или атомы диссоциируют на ионы, которые становятся движущимися по раствору.
Среди электролитов можно выделить две основные категории: кислоты и соли. Кислоты образуются из водорода и кислотных остатков, а соли состоят из катионов и анионов, образованных от щелочных металлов и кислотных радикалов.
Важно понимать, что не все вещества являются электролитами. Некоторые вещества могут быть плохими проводниками электрического тока или вообще не проводить ток. Например, большинство органических веществ, таких как углеводы, жиры и протеины, не проводят электрический ток. Также нет электрической проводимости у растворов некоторых инорганических веществ, таких как нитраты и сульфиты.
Электролиты: свойства и применение
Многие реакции и процессы, происходящие в природе и в промышленности, связаны с использованием электролитов. Они могут быть использованы в качестве электролитического раствора, электролитического геля или электролитической соли. Электролитические растворы применяются в различных областях, включая химическую и биохимическую промышленность, электролитическую обработку поверхностей, батареи и аккумуляторы, а также в медицине и аналитической химии.
Биохимические процессы и жизнедеятельность организмов основаны на наличии электролитов в организационных структурах. Ионы электролитов играют важную роль в поддержании электрохимического потенциала клеток, участвуют в передаче нервных импульсов и контроле сократительной активности мышц. Кроме того, электролиты влияют на уровень pH организма и участвуют в регуляции многих физиологических процессов.
Использование электролитов в различных областях науки и промышленности неразрывно связано с изучением и пониманием их свойств и поведения. Они могут быть классифицированы по своей природе – органические и неорганические электролиты, по типу ионов, которые они могут образовывать, а также по степени ионизации. Понимание свойств и поведения электролитов является важной задачей для разработки новых материалов и технологий, а также для оптимизации процессов в различных отраслях промышленности.
Что такое электролиты
При растворении электролитов в воде, молекулы вещества разделяются на ионы положительного и отрицательного заряда, которые свободно перемещаются в растворе под влиянием электрического поля. Способность вещества образовывать ионы определяется его химической структурой и валентностью атомов.
Электролиты играют важную роль в многих процессах, происходящих в живых организмах и в технике. В биологии, например, электролиты необходимы для поддержания нормального состояния клеток и функционирования органов. В технике, электролиты используются в батареях, аккумуляторах и электролитических процессах.
Важно отметить, что существуют различные типы электролитов, такие как сильные электролиты (полностью ионизируются в растворе) и слабые электролиты (частично ионизируются в растворе). Кроме того, растворы, содержащие электролиты, могут иметь различные концентрации и pH-значения, что влияет на их электропроводность и химические свойства.
Определение электролитов
Электролитами называются вещества, которые, когда они растворяются в воде или других растворителях, образуют ионы и могут проводить электрический ток. Электролиты могут быть как кислотами, так и щелочами, солями или другими соединениями.
Когда электролит растворяется в воде, он расщепляется на положительно заряженные катионы и отрицательно заряженные анионы. Катионы и анионы образуют электролитическое растворение, которое позволяет проводить электрический ток через раствор.
Различают сильные и слабые электролиты. Сильные электролиты полностью расщепляются на ионы в растворе и имеют высокую электропроводность. Слабые электролиты расщепляются на ионы лишь частично и имеют низкую электропроводность.
Определение электролитов имеет важное значение в химическом анализе и в различных областях применения, таких как медицина, фармакология и сельское хозяйство. Знание свойств электролитов помогает понять их воздействие на организм и использовать их в различных процессах и технологиях.
Типы электролитов
Согласно своей химической природе электролиты можно разделить на 3 типа:
| 1. Ионные электролиты | Это вещества, растворы которых содержат положительно и отрицательно заряженные ионы. Примеры таких электролитов — соли, кислоты и щелочи. |
| 2. Молекулярные электролиты | Это вещества, растворы которых содержат незаряженные молекулы, способные проводить электрический ток. Примеры молекулярных электролитов — некоторые кислоты, основания и сахары. |
| 3. Полупроводниковые электролиты | Это вещества, которые могут приводить к проведению электрического тока только при определенных условиях, например, при повышенной температуре или наличии электрического поля. |
Все эти типы электролитов имеют значительное значение в различных областях науки и техники, таких как химия, физика, медицина и электротехника.
Проводимость электролитов
Проводимость электролитов обусловлена наличием свободных движущихся заряженных частиц – ионов. В растворе эти ионы образуют электронный газ, который может переносить электрический ток. При подключении электрической цепи, ионы начинают перемещаться к электродам, тем самым создавая электрический ток.
Проводимость электролитов зависит от некоторых факторов, таких как концентрация электролита, его ионизация, температура и размеры ионов. Чем выше концентрация электролита, тем выше его проводимость. Iонизация, то есть способность электролита образовывать ионы в растворе, также влияет на проводимость. Высокая температура способствует увеличению проводимости, а увеличение размеров ионов, наоборот, уменьшает её.
Важно отметить, что проводимость электролитов связана не только с растворами, но и с другими формами электролитов, такими как плавы, расплавы и некоторые газы.
Механизм проводимости
Вода, как известно, является полюсным растворителем и обладает дипольными свойствами. Положительно заряженный ион притягивается к отрицательно поляризованному кислороду, а отрицательно заряженный ион – к положительно поляризованному водороду. Такое взаимодействие, называемое гидратацией, обуславливает устойчивость ионов в растворе и позволяет им свободно перемещаться.
Проводимость электролита зависит от концентрации и заряда ионов, а также от подвижности этих ионов в растворе. Чем больше концентрация ионов, тем выше проводимость электролита. Подвижность ионов определяется их зарядом и размерами, а также взаимодействием с растворителем.
| Тип электролита | Примеры веществ |
|---|---|
| Сильный электролит | Соляная кислота (HCl), серная кислота (H2SO4), хлорид натрия (NaCl) |
| Слабый электролит | Уксусная кислота (CH3COOH), угольная кислота (H2CO3) |
| Несмотря на относительно низкую проводимость, слабые электролиты могут использоваться во множестве процессов, таких как титрование и синтез определенных веществ. |
Влияние концентрации на проводимость
При увеличении концентрации раствора, количество ионов или молекул, способных перемещаться в растворе, также увеличивается. Это происходит из-за того, что большее количество растворенного вещества образует большее количество растворенных ионов, которые могут быть носителями электрического заряда и перемещаться под воздействием электрического поля.
Таким образом, при увеличении концентрации раствора можно наблюдать увеличение электропроводности, поскольку увеличивается число ионов или молекул, способных проводить электрический ток. Однако следует отметить, что при очень высоких концентрациях раствора может происходить обратная зависимость, связанная с факторами, такими как ионная сила раствора и насыщение раствора. Данные факторы могут ограничить дальнейшее увеличение электропроводности при дальнейшем увеличении концентрации раствора.
Применение электролитов
Одно из основных применений электролитов — это в батареях и аккумуляторах. Благодаря электролитам, батареи могут хранить и выделять энергию, а аккумуляторы могут быть перезаряжаемыми и использоваться во множестве устройств, от мобильных телефонов до электромобилей.
Электролиты также используются в различных химических процессах. Например, в электролизе — процессе разложения вещества под действием электрического тока, электролиты принимают активное участие и являются необходимыми для его проведения. Также электролиты применяются в гальванической обработке поверхности металлов, где они играют роль проводника в электрохимической реакции.
Для поддержания электролитического баланса в организме врачи применяют инфузии электролитов. Это особенно важно в случае обезвоживания или нарушения электролитического баланса из-за различных заболеваний.
Кроме того, электролиты используются в косметической промышленности. В шампунях, гелях и других косметических средствах электролиты улучшают смачивание, стабилизируют текстуру и увлажняют кожу и волосы.
| Применение | Пример |
|---|---|
| Батареи | Литиевые и свинцово-кислотные аккумуляторы |
| Химические процессы | Электролиз, гальваническая обработка |
| Медицина | Инфузии электролитов для поддержания баланса |
| Косметика | Шампуни, гели, увлажняющие кремы |
Использование в батареях
Одним из наиболее распространенных типов батарей являются щелочные батареи. В таких батареях электролитом служит щелочное растворение, часто на основе гидроксида калия или гидроксида натрия. Щелочные батареи широко используются в различных бытовых устройствах, таких как пульты дистанционного управления, наушники, фонари и другие электронные устройства. Они обладают высокой энергетической плотностью и длительным сроком службы.
Литий-ионные аккумуляторы являются еще одним примером батарей, которые используют электролиты для передачи заряда. Эти аккумуляторы работают на основе лития и имеют высокую плотность энергии, что делает их идеальным выбором для портативных устройств, таких как мобильные телефоны, ноутбуки и планшеты. Они также широко используются в электромобилях и солнечных батареях для хранения энергии.
Еще одним типом батарей, использующих электролиты, являются свинцово-кислотные аккумуляторы. В таких батареях электролитом служит раствор сульфата свинца и серной кислоты. Они широко применяются в автомобильной промышленности для пусковых аккумуляторов и в энергетических системах с низким уровнем электрической нагрузки.
Вопрос-ответ:
Какие вещества являются электролитами?
Электролитами являются вещества, которые могут ионизироваться в растворе и проводить электрический ток. К ним относятся соли, кислоты, щелочи и некоторые другие соединения.
Что значит ионизация в растворе?
Ионизация в растворе означает, что вещество распадается на ионы, приобретая способность проводить электрический ток. Таким образом, положительные ионы (катионы) и отрицательные ионы (анионы) образуются в растворе и перемещаются под воздействием электрического поля.
Какие растворы проводят электрический ток?
Растворы электролитов проводят электрический ток, так как содержат ионы, которые перемещаются в растворе под влиянием электрического поля. Растворы некоторых неэлектролитов, таких как сахар или спирт, не проводят электрический ток, так как не образуют ионов в растворе.
Каким образом происходит проведение электрического тока в растворах электролитов?
При подключении электрического поля к раствору электролита, положительные ионы перемещаются к отрицательному электроду (аноду), а отрицательные ионы перемещаются к положительному электроду (катоду). Это движение ионов создает электрический ток в растворе электролита.
Какие свойства имеют растворы электролитов?
Растворы электролитов имеют такие свойства, как электропроводность, способность к электролизу, изменение свойств под действием электрического поля и т. д. Они также могут обладать кислотными, щелочными или нейтральными свойствами.