
Гидролиз – это химическая реакция, при которой вещество разлагается на составляющие его части при взаимодействии с водой или водным раствором. Термин «гидролиз» происходит от греческих слов «гидро» (вода) и «лизис» (разложение). Этот процесс широко распространен в природе и важен для понимания многих химических и биологических явлений.
Примеры гидролиза можно обнаружить повсюду в повседневной жизни:
1. Гидролиз в пищеварительной системе: Во время пищеварения, реакции гидролиза разлагают сложные молекулы пищи на простые соединения. Например, углеводы гидролизуются до образования глюкозы, белки гидролизуются до аминокислот, а жиры гидролизуются до глицерина и жирных кислот.
2. Гидролиз солей: Когда соль растворяется в воде, происходит гидролиз ее компонентов. Например, гидролиз карбоната натрия приводит к образованию гидроксида натрия и углекислого газа.
3. Гидролиз эфиров: Эфиры могут быть гидролизованы до образования соответствующих спиртов и карбоновых кислот. Например, этот процесс используется при производстве мыла из растительных масел.
Гидролиз является основой для понимания многих химических реакций и процессов, а также имеет широкое применение в различных отраслях, включая пищевую промышленность, химию и биологию.
Понятие гидролиза в химии
Гидролиз может быть как обратимым, так и необратимым. Обратимый гидролиз означает, что реакция может происходить в обоих направлениях, в то время как необратимый гидролиз означает, что реакция происходит только в одном направлении.
Примеры гидролиза включают взаимодействие кислоты и щелочи с водой. Когда кислота гидролизируется, водородные ионы (H+) отщепляются от кислоты и присоединяются к молекулам воды, образуя гидроксониевые ионы (H3O+). В случае гидролиза щелочи, гидроксидные ионы (OH-) отщепляются и соединяются с протонами (H+) воды, образуя неполярную молекулу воды и ионы гидроксония.
Гидролиз также может происходить вместе с другими важными химическими реакциями, такими как конденсация и биологические процессы. Важно отметить, что гидролиз является одним из основных механизмов, позволяющих живым организмам разлагать сложные молекулы для получения энергии и синтезировать новые соединения.
Определение и примеры гидролиза
Примеры гидролиза включают реакцию гидролиза солей, кислот и эфиров. Например, гидролиз соли хлорида натрия приводит к образованию кислоты соляной и щелочи натрия:
NaCl + H2O -> NaOH + HCl
Гидролиз кислоты может привести к образованию кислоты и спирта:
CH3COOH + H2O -> CH3COOH + H3O+
Гидролиз эфира может привести к образованию спирта и кислоты:
C2H5OC2H5 + H2O -> 2C2H5OH + H2O
Гидролиз – это важный процесс в химии, который играет роль во многих биологических и промышленных процессах.
Основные типы гидролиза
1. Кислотный гидролиз
Кислотный гидролиз – это реакция гидролиза, которая происходит при участии кислоты. В результате этой реакции молекулы вещества разрушаются на части под действием воды и образуются ионы. К примеру,\
Механизм гидролиза
Примеры гидролиза
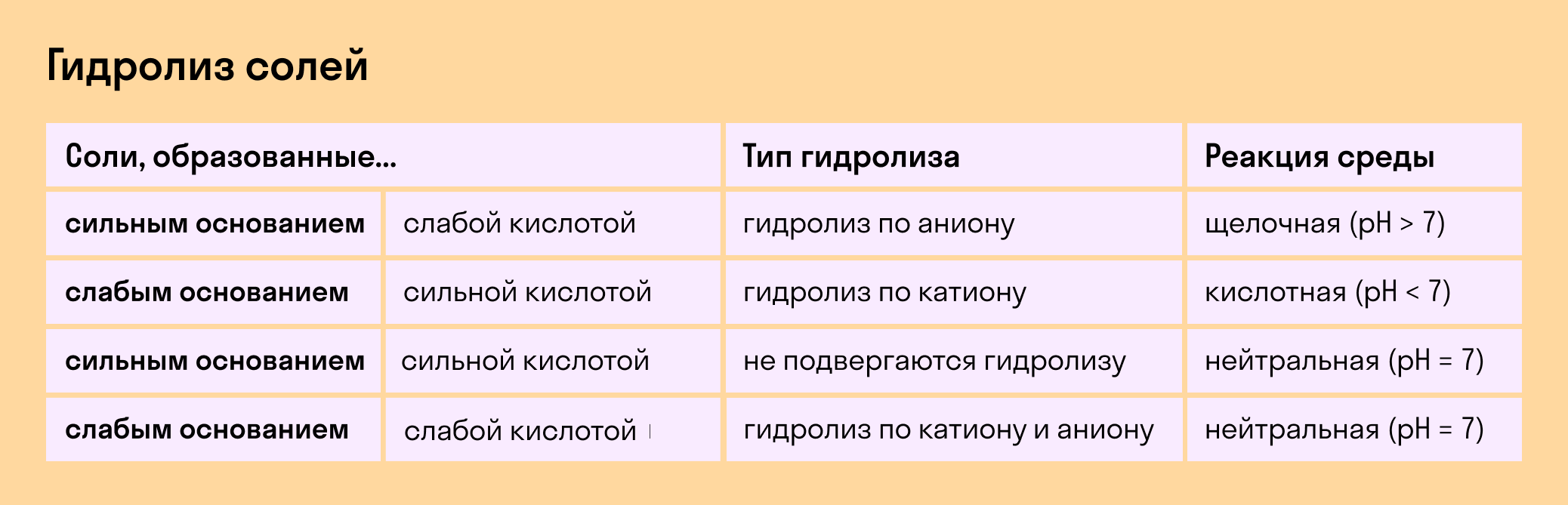
Гидролиз может происходить как с солями, так и с эфирами, эстерами и другими органическими соединениями. Рассмотрим примеры гидролиза:
- Гидролиз солей: при растворении солей в воде их ионные связи разрушаются, что приводит к образованию кислоты и основного вещества.
- Гидролиз эфиров: эфиры взаимодействуют с водой, образуя соответствующие кислоты и спирты.
- Гидролиз эстеров: эстеры под воздействием воды расщепляются на кислоты и спирты.
Механизм гидролиза солей
Гидролиз солей происходит в двух стадиях. Вначале ионы соли расслаиваются в растворе, а затем происходит дальнейшая реакция между полученными ионами и молекулами воды.
- Расслаивание соли: между ионами соли и молекулами воды возникают адгезионные силы. В результате разрушения ионных связей происходит расслаивание ионов вещества в растворе.
- Гидролиз ионов: расслаившиеся ионы взаимодействуют с молекулами воды, приводя к образованию кислоты и основного вещества. В зависимости от реакции гидролиза, раствор может быть кислотным, щелочным или нейтральным.
Таким образом, механизм гидролиза является важным процессом в химии, который позволяет расщепить вещества и получить новые соединения.
Влияние pH на гидролиз
Влияние pH на гидролиз обусловлено тем, что различные виды гидролиза могут происходить в разных pH-условиях. Например, гидролиз эстеров происходит при кислых условиях (низкий pH), а гидролиз солей происходит при щелочных условиях (высокий pH).
Кроме того, pH раствора может изменять скорость гидролиза. Например, высокий pH может ускорить гидролиз эстеров, а низкий pH может замедлить этот процесс. Это связано с тем, что pH влияет на химическую активность вещества и определенные реакции происходят более быстро при определенных pH-значениях.
Важно учесть, что не все соединения подвержены гидролизу при изменении pH. Некоторые соединения могут быть стабильными и не подвергаться гидролизу даже при экстремальных pH-условиях.
Роль гидролиза в живых системах
В клетках организмов гидролиз используется для обеспечения энергетических нужд клетки, синтеза новых молекул, разрушения старых и поврежденных структур, а также для регуляции метаболических процессов.
Одним из важных примеров гидролиза в живых системах является гидролиз белков. Белки, содержащиеся в пище, разлагаются на аминокислоты под воздействием пищеварительных ферментов. Эта реакция гидролиза позволяет организму получить необходимые для жизни аминокислоты и строительные блоки для синтеза новых белков.
Гидролиз также играет важную роль в гидролизе нуклеиновых кислот, таких как ДНК и РНК. Данный процесс позволяет клетке активировать или деактивировать гены, контролирующие различные биологические процессы.
Гидролиз жирных кислот является важной реакцией для получения энергии в клетках. В результате гидролиза жирных кислот образуется урантовая кислота, которая затем претерпевает бета-окисление, высвобождая энергию, необходимую для работы организма.
Таким образом, гидролиз является неотъемлемой частью жизнедеятельности организмов и играет важную роль в обмене веществ, синтезе новых молекул и энергетическом обеспечении клеток.
Значение гидролиза в производстве
Области применения гидролиза в производстве:
- Производство пищевых продуктов. В пищевой промышленности гидролиз используется для расщепления сложных органических соединений на более простые. Это позволяет улучшить вкус, аромат и свойства продуктов.
- Производство химических веществ. Гидролиз применяется для получения различных химических соединений, таких как соляные и серной кислоты, оснований и многих других веществ.
- Производство лекарственных препаратов. В фармацевтической промышленности гидролиз используется для получения активных ингредиентов, разрушения молекулярных связей и модификации химической структуры лекарственных веществ.
Применение гидролиза позволяет улучшить качество и свойства различных продуктов, снизить затраты на производство и расширить ассортимент выпускаемой продукции. Важно отметить, что управление гидролизом в производстве требует специальных знаний и навыков, чтобы обеспечить желаемый продукт и избежать нежелательных реакций.
Последствия гидролиза и его применение в анализе
Последствия гидролиза

Гидролиз может привести к изменению свойств вещества и образованию новых соединений. В результате гидролиза могут образовываться кислоты или щелочи, что может изменить pH раствора. Также гидролиз может способствовать разрушению сложных соединений на более простые молекулы.
Применение гидролиза в анализе
Гидролиз часто используется в аналитической химии для определения состава вещества. Множество методов анализа основаны на реакциях гидролиза. Например, гидролиз может быть использован для определения содержания определенных ионов в растворе или для разложения сложных органических соединений на более простые молекулы.
Также гидролиз может быть использован для исследования биологических процессов. Например, гидролиз рибонуклеиновой кислоты может помочь в понимании структуры и функции генов.
Однако гидролиз может быть как полезным, так и нежелательным процессом. При производстве пищевых продуктов, гидролиз может быть использован для улучшения их вкуса или текстуры. Однако в некоторых случаях, гидролиз может вызывать разложение продуктов и приводить к потере качества их консервации.
Вопрос-ответ:
Что такое гидролиз?
Гидролиз — это химическая реакция, при которой соединение разлагается на составляющие его компоненты при участии молекул воды.
Как происходит гидролиз?
Гидролиз происходит путем взаимодействия молекулы соединения с молекулами воды. В результате этой реакции молекула разлагается на две или более новых молекулы.
Какие вещества могут подвергаться гидролизу?
Гидролиз может происходить со многими веществами, включая соли, эфиры и связи между атомами в полимерах.
Какие факторы влияют на скорость гидролиза?
Скорость гидролиза зависит от концентрации реагирующих веществ, температуры, растворителя и наличия катализаторов. Высокая концентрация реагентов, высокая температура, использование подходящего растворителя и наличие катализаторов обычно увеличивают скорость гидролиза.
Какие примеры гидролиза вы знаете?
Некоторые примеры гидролиза включают гидролиз солей (например, образование кислот из солей металла), гидролиз эфиров (разложение эфиров на спирты и кислоты) и гидролиз сложных углеводов (например, разложение крахмала на глюкозу).
Что называется гидролизом?
Гидролиз – это химическая реакция, которая происходит при взаимодействии вещества с водой. В результате этой реакции вещество распадается на ионы или молекулы, которые образуются при разрыве химических связей в молекуле вещества. Гидролиз широко распространен в природе и играет важную роль в жизнедеятельности организмов, а также в промышленности и химической науке.