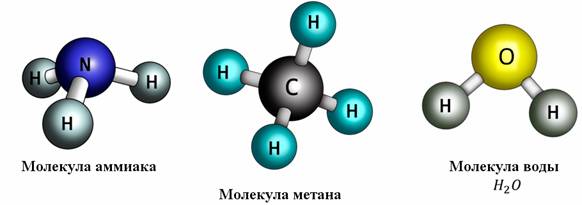
Молекулы — это основные строительные блоки химических веществ. Они образуются из более мелких единиц, называемых частицами. Частицы могут быть разных типов, включая атомы, ионы и многоатомные ионы.
Атомы являются наименьшими частицами вещества и не могут быть дальше разделены химическими методами. Они состоят из протонов, нейтронов и электронов, которые вместе образуют ядро атома и его облако электронов. Различные атомы имеют разное количество протонов, нейтронов и электронов, что определяет их химические свойства.
Атомы могут соединяться между собой, образуя молекулы. Молекулы состоят из двух или более атомов, связанных между собой химическими связями. Когда атомы соединены в молекулу, они образуют новое вещество со своими уникальными свойствами.
Ионы – это атом или группа атомов, которая получила или потеряла один или несколько электронов. Ионы имеют электрический заряд и могут притягивать или отталкивать другие ионы или молекулы. Ионы могут образовывать соединения с другими ионами или нейтральными атомами, образуя сложные структуры и вещества.
Все эти частицы – атомы, ионы и многоатомные ионы – играют важную роль в химии и определяют свойства вещества. Через исследование этих частиц и их взаимодействий мы можем лучше понять мир вокруг нас и создавать новые материалы и соединения с желаемыми свойствами.
Молекулы, состоящие из частиц
Элементарные молекулы состоят из одного типа атомов, например, молекулы кислорода (O₂) или молекулы азота (N₂). Эти молекулы содержат только атомы одного элемента и являются химическими представителями соответствующего вещества.
Сложные молекулы содержат несколько разных типов атомов, которые соединены между собой. Примером таких молекул является вода (H₂O), состоящая из атомов водорода (Н) и атомов кислорода (О). Сложные молекулы обладают более сложной структурой и могут иметь различные свойства и функции.
Важно отметить, что молекулы могут состоять из разного числа атомов, и это число определяет их формулу. Молекулы с одинаковой формулой могут иметь различные структуры и свойства. Изучение молекул и их свойств является одним из основных направлений химии.
Элементы в таблице Менделеева
Строение таблицы Менделеева
Таблица Менделеева содержит строки, называемые периодами, и столбцы, называемые группами. Каждый элемент в таблице имеет свой атомный номер, химический символ и атомную массу. Строение таблицы Менделеева позволяет легко классифицировать и организовывать элементы по их свойствам и химическим реакциям.
Нотация элементов
Химические элементы в таблице Менделеева обозначаются специальными символами, которые обычно являются аббревиатурами латинских или английских названий элементов. Например, водород обозначается символом H, кислород — символом O, а углерод — символом C.
Физические и химические свойства
Каждый элемент в таблице Менделеева имеет уникальные физические и химические свойства. Некоторые элементы являются металлами, другие — неметаллами, а некоторые — полуметаллами. Они также отличаются по своей реактивности, плотности, точке плавления и кипения, способности проводить электрический ток и т.д.
Использование элементов
Элементы в таблице Менделеева широко используются в различных областях науки и промышленности. Некоторые элементы, такие как кислород, углерод и азот, необходимы для жизни организмов. Другие элементы, такие как железо и алюминий, используются для производства различных материалов и изделий.
- Некоторые элементы, такие как золото и серебро, используются в ювелирном искусстве.
- Некоторые элементы, такие как железо и медь, используются в строительстве и производстве машин.
- Другие элементы, такие как кремний и фосфор, используются в производстве электроники и полупроводников.
Эти примеры демонстрируют важность и разнообразие использования элементов в разных областях нашей жизни.
Открытие новых элементов
Все элементы в таблице Менделеева были открыты и названы учеными. Некоторые элементы были открыты еще в древности, например, золото и серебро. Другие элементы были открыты в последние столетия благодаря современным методам исследования. Находка и открытие новых элементов продолжается, и некоторые элементы в таблице Менделеева все еще открыты только недавно.
Моноатомные газы
Молекулы некоторых газов состоят из одного атома и называются моноатомными газами. Они обладают особыми свойствами и играют важную роль в различных областях науки и технологий.
Особенности моноатомных газов
Моноатомные газы включают такие вещества, как гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Они отличаются от молекулярных газов, таких как кислород (O2), азот (N2) или водород (H2), тем, что состоят из одного атома, который является базовой единицей в их структуре.
Моноатомные газы обладают высокой степенью инертности, то есть они мало взаимодействуют с другими веществами. Это делает их полезными в ряде приложений, таких как заполнение ламп или использование в качестве рабочих газов в электронных приборах.
Применение моноатомных газов
Моноатомные газы используются в различных областях науки и технологий. Например, гелий широко применяется в аэростатике и медицинской диагностике, аргон используется в сварке и обработке материалов, а радон применяется в радиоактивных терапиях.
Кроме того, моноатомные газы могут иметь интересные свойства при низких температурах и высоких давлениях. Например, гелий при очень низких температурах становится супертекучим, что позволяет использовать его в качестве охлаждающего средства в различных экспериментах и технических устройствах.
Таким образом, моноатомные газы являются важными компонентами современной науки и технологий. Понимание их свойств и применение открывают новые возможности для исследования и развития научных отраслей и промышленности.
Молекулы, состоящие из атомов одного элемента
В отличие от большинства молекул, состоящих из атомов разных элементов, молекулы, состоящие из атомов одного элемента, обладают особыми свойствами.
Уникальные свойства таких молекул объясняются тем, что все атомы в молекуле имеют одинаковую природу и химические связи между ними образуются с участием одного и того же вида атомов.
Например, молекула кислорода (O2) состоит из двух атомов кислорода, а молекула азота (N2) — из двух атомов азота.
Такие молекулы обычно обладают высокой химической стабильностью и являются главными компонентами веществ, которые состоят из одного элемента.
Молекула, состоящая из атомов одного элемента, имеет определенный размер и форму, которые определяются строением и расположением атомов в молекуле.
Органические молекулы
Органические молекулы представляют собой частицы, состоящие из атомов углерода и водорода. Впервые термин «органические» был предложен в XVIII веке для обозначения соединений, получаемых из организмов, таких как животные и растения.
Структура органических молекул
Органические молекулы имеют сложную структуру, которая определяется через взаимодействие и размещение атомов углерода и водорода в молекуле. Каждый атом углерода может образовывать более двух связей с другими атомами, что позволяет создавать разнообразные углеродные цепи и кольца.
Органические молекулы могут иметь различные функциональные группы, такие как аминогруппы, карбонильные группы, карбоксильные группы и др. Эти функциональные группы определяют химические свойства и реакционную способность органических молекул.
Важность органических молекул
Органические молекулы имеют огромное значение для жизни на Земле. Они являются основными компонентами биологических молекул, таких как белки, углеводы, липиды и нуклеиновые кислоты. Органические молекулы также используются в различных отраслях промышленности, таких как пищевая, фармацевтическая и пластическая.
| Первый столбец | Второй столбец |
|---|---|
| Ячейка 1 | Ячейка 2 |
| Ячейка 3 | Ячейка 4 |
Сложные органические соединения
Молекулы сложных органических соединений состоят из частиц, называемых атомами.
Атомы, в свою очередь, могут быть образованы различными элементами, такими как углерод, водород, кислород и многими другими.
Сочетание атомов в молекуле определяет ее структуру и свойства. Сложные органические соединения обладают большим количеством атомов, каждый из которых может быть связан с другими атомами через химические связи.
Примеры сложных органических соединений:
| Название соединения | Формула |
|---|---|
| Белки | (CHON) |
| Углеводы | (CH2O) |
| Липиды | (C3H5COOH) |
| Нуклеиновые кислоты | (CHONP) |
Сложные органические соединения играют важную роль в живых организмах, так как являются основными компонентами клеток и выполняют различные функции, включая участие в обмене веществ, передачу генетической информации и поддержание структуры организма.
Неорганические соединения
Свойства неорганических соединений
Неорганические соединения обладают разнообразными свойствами, которые определяют их использование в различных областях.
Некоторые неорганические соединения обладают высокой электропроводностью и используются в электронике и электротехнике. Другие соединения обладают красящими свойствами и используются в производстве красок и пигментов. Еще одно важное свойство неорганических соединений – их химическая стабильность, что делает их полезными для создания материалов с высокой стойкостью к воздействию различных факторов окружающей среды.
Примеры неорганических соединений
| Категория неорганических соединений | Примеры соединений |
|---|---|
| Оксиды | SiO2, Al2O3, CO2 |
| Соляные соединения | NaCl, MgCl2, K2SO4 |
| Карбиды | CaC2, SiC, WC |
| Нитриды | BN, Si3N4, GaN |
Это лишь небольшая часть разнообразных неорганических соединений, которые используются в научных и промышленных целях. Их широкое применение делает их незаменимыми компонентами в различных отраслях техники и науки.
Бинарные соединения
Атомы, составляющие бинарные соединения, могут быть связаны различными типами химических связей, такими как ионная, ковалентная или металлическая связь. В зависимости от типа связи, бинарные соединения могут иметь различные физические и химические свойства.
Бинарные соединения играют важную роль в химии и имеют широкое применение в различных областях, включая фармацевтику, промышленность, электронику и строительство. Они могут быть использованы для создания новых материалов, получения лекарственных препаратов, катализа химических реакций и других процессов.
Существует большое количество бинарных соединений, включая оксиды, сульфиды, галогениды, азотиды и другие. Они имеют различные названия в зависимости от состава и типа связей, например, карбиды, нитриды, фториды, хлориды и т.д.
Вопрос-ответ:
Какие частицы составляют молекулы?
Молекулы состоят из атомов, которые связаны между собой различными химическими связями.
Что определяет структуру молекулы?
Структуру молекулы определяют типы и последовательности связей между атомами, а также их трехмерное расположение в пространстве.
Какие частицы изначально образуют атомы?
Атомы образуются из элементарных частиц, таких как протоны, нейтроны и электроны, которые, в свою очередь, состоят из кварков и лептонов.
Что значит термин «химическая связь»?
Химическая связь это электростатическое притяжение между атомами, которое позволяет им образовать молекулы.