Щелочноземельные металлы — это группа элементов периодической таблицы, которые имеют уникальные собственности и найдены только в небольших количествах в природе. Вот уже несколько веков исследователи задаются вопросом: почему эти элементы были названы «щелочноземельными»? Чтобы понять их происхождение, нужно провести анализ истории открытия и собственно свойств этих удивительных металлов.
Элементы группы щелочноземельных металлов включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Такое грандиозное название происходит из сочетания слов «щелочных» и «земельных», которое отражает их химические и физические свойства, а также способ взаимодействия с окружающей средой.
«Щелочные» металлы получили это название из-за способности образовывать щелочные растворы при взаимодействии с водой. Так, кальций, барий и стронций реагируют с водой, образуя газ и щелочной раствор. Во время исследований в 18 веке, ученые заметили, что часто использовались именно эти элементы для образования сильно щелочных растворов, что в итоге сформировало их название.
Почему щелочноземельные металлы получили такое название?
Они получили свое название «щелочноземельные» из-за своих химических свойств.
Первое слово, «щелочные», связано с основным характером растворимых оксидов этих металлов. Щелочноземельные металлы имеют низкую электроотрицательность, что делает их очень реактивными и способными образовывать ионы с положительным зарядом (катионы). Эти катионы реагируют с водой, образуя щелочные растворы. Подобные растворы, которые образуются при растворении щелочноземельных металлов, имеют щелочную реакцию и широко используются в различных областях, таких как промышленность, медицина и сельское хозяйство.
Второе слово, «земельные», происходит от термина «земля», который использовался в древности для обозначения оксидов металлов. Исходно такие оксиды получали из природы, а не из руды, и были наиболее распространены в земной коре. Щелочноземельные металлы имеют оксиды, которые придают земляному цвету окрашенным стеклам, что служит еще одной исторической причиной использования термина.
Таким образом, название «щелочноземельные металлы» объединяет особенности химических свойств и происхождение оксидов этих элементов.
История и происхождение названия щелочноземельных металлов
Причиной названия «щелочноземельные» является тот факт, что эти металлы очень похожи на щелочные металлы, но имеют большую плотность и твёрдость. Как и щелочные металлы, щелочноземельные металлы реагируют с водой, но при этом они не такие активные и не взрываются при контакте с ней. В прошлом щелочноземельные металлы использовались для получения щелочей, которые получали путем обработки их оксидов щелочью. В связи с этим название «щелочноземельные металлы» было придумано именно для этой группы элементов.
Само название «щелочноземельные» отражает сходство этих металлов со щелочными металлами и их способность образовывать оксиды, которые имеют щелочные свойства. Однако, несмотря на это сходство, щелочноземельные металлы обладают и некоторыми существенными различиями от щелочных металлов, как, например, большей плотностью и твёрдостью.
Итак, название «щелочноземельные металлы» получили из-за их свойств образовывать оксиды, которые имеют щелочные свойства, их сходства с щелочными металлами, а также из-за исторического использования их оксидов для получения щелочей.
Нимбус щелочных металлов
Щелочные металлы, такие как литий, натрий, калий и др., получили свое название из-за их химических свойств и распространенного встречания в природе. Используется термин «щелочные» благодаря тому, что эти металлы образуют гидроксиды с щелочной реакцией при взаимодействии с водой.
Основными свойствами щелочных металлов являются их низкая плотность, мягкость и низкая температура плавления. Эти металлы легко реагируют с кислородом и водой, образуя гидроксиды, где основным компонентом выступает гидроксид щелочного металла.
Благодаря своим химическим свойствам, щелочные металлы нашли широкое применение в различных областях, включая производство щелочных батарей, сплавов для легких конструкций, а также в медицине и фармацевтике.
Щелочные металлы также являются важными элементами в химических реакциях и исследованиях. Они используются в качестве катализаторов и реагентов в различных синтезах и химических процессах. Благодаря своей реактивности, щелочные металлы часто привлекают внимание ученых и инженеров.
Нимбус щелочных металлов основан на их уникальных свойствах и ролях в современных технологиях и научных исследованиях. Изучение и применение щелочных металлов продолжает развиваться, что способствует развитию новых материалов, процессов и технологий с более высокой эффективностью и экологической безопасностью.
Щелочь и земля в названии металлов
Первое слово в названии – «щелочь» – отражает свойство этих металлов образовывать щелочные растворы при реакции с водой. При взаимодействии с водой щелочноземельные металлы выделяются водородом и образуют гидроксиды, которые в свою очередь растворяются в воде и дают растворы с щелочной реакцией.
Второе слово в названии – «земля» – объясняется тем, что изначально металлы этой группы были получены из минералов, которые назывались землями. Эти минералы являются оксидами соответствующих металлов и обладают землянистым видом, отсюда их название.
Соединение слов «щелочь» и «земля» в названии металлов отражает основные свойства и происхождение этих элементов. Изучение щелочноземельных металлов способствует развитию различных областей науки и технологии, а также находит применение во многих сферах, от промышленности до медицины.
| Металл | Атомный номер | Атомная масса |
|---|---|---|
| Бериллий (Be) | 4 | 9.0122 |
| Магний (Mg) | 12 | 24.305 |
| Кальций (Ca) | 20 | 40.078 |
| Стронций (Sr) | 38 | 87.62 |
| Барий (Ba) | 56 | 137.327 |
| Радий (Ra) | 88 | 226 |
Химические свойства и особенности щелочноземельных металлов
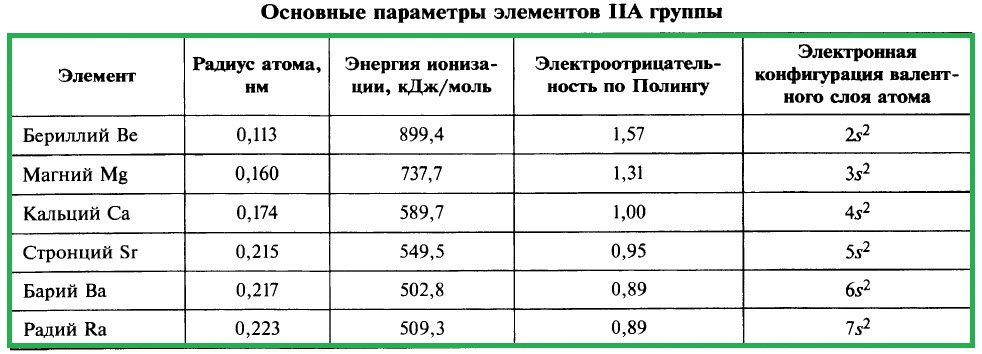
Химические свойства щелочноземельных металлов во многом определяются их электронной конфигурацией. Они имеют два электрона в валентной оболочке, что делает их более реактивными по сравнению с другими металлами. Они издают характерные звуки при контакте с водой и могут высвобождать водород.
Особенностью щелочноземельных металлов является низкая плотность и низкая температура плавления. Некоторые из них более легкие, чем вода, и могут плавать на поверхности воды. Они также обладают низкой твердостью и мягкостью, поэтому их можно резать ножом. Однако они реагируют с воздухом и влагой, поэтому должны храниться в специальной среде или под слоем масла.
Щелочноземельные металлы образуют стабильные соединения с кислородом, образуя оксиды. Они также образуют соли с кислотами и реагируют с веществами, содержащими кислород, серу и галогены. Они способны образовывать двухвалентные и однозначные соединения в своих соединениях.
| Элемент | Атомный номер | Относительная атомная масса | Плотность (г/см³) | Температура плавления (°C) |
|---|---|---|---|---|
| Бериллий | 4 | 9,0122 | 1,85 | 1287 |
| Магний | 12 | 24,305 | 1,74 | 650 |
| Кальций | 20 | 40,078 | 1,55 | 842 |
| Стронций | 38 | 87,62 | 2,63 | 769 |
| Барий | 56 | 137,33 | 3,62 | 727 |
| Радий | 88 | 226 | 5 | 700 |
Таким образом, щелочноземельные металлы обладают рядом уникальных химических свойств и особенностей, делающих их важными и широко применяемыми в различных областях науки и промышленности.
Реакция с водой и взрывоопасность
Щелочноземельные металлы характеризуются высокой реактивностью при контакте с водой. Поэтому они нередко называются «щелочными» металлами. Именно благодаря этой характеристике они находят широкое применение в различных областях науки и техники.
Когда щелочноземельные металлы взаимодействуют с водой, происходит интенсивное выделение водорода. Этот процесс сопровождается ярким пламенем и высокой температурой, что делает его весьма впечатляющим и опасным. На солнце они могут даже взорваться при попадании на воду.
Взрывоопасность щелочноземельных металлов обусловлена их высокой реактивностью. При взаимодействии с водой происходит быстрое образование гидроксида металла и выделение водорода. Воспламенение водорода может привести к взрыву.
В качестве примера можно привести реакцию магния с водой. При взаимодействии магния с водой образуется гидроксид магния и высвобождается водород. При этом возникает яркое пламя, и происходит быстрое повышение температуры.
| Реакция магния с водой: |
|---|
| Mg + 2H2O → Mg(OH)2 + H2 |
Благодаря своей высокой реактивности и способности взрываться в присутствии воздуха и других веществ, щелочноземельные металлы используются в производстве пиротехнических смесей, фейерверков, ракетных двигателей и других взрывчатых веществ. Также они применяются в качестве воспламеняющих смесей для поджигания реактивных смесей. Однако в промышленности работа с такими веществами требует особой осторожности и соблюдения мер предосторожности.
Важно отметить, что взаимодействие щелочноземельных металлов с водой должно проводиться под контролем и с соблюдением всех безопасных условий. Несоблюдение правил безопасности может привести к серьезным последствиям, вплоть до пожара и взрыва.
Способность образовывать соединения
Щелочноземельные металлы обладают высокой способностью образовывать соединения с другими элементами. Их внешняя электронная оболочка содержит два электрона, которые легко могут быть отданы или приняты другими атомами, что позволяет щелочноземельным металлам образовывать ионы положительного заряда.
Эти металлы реактивны и активно вступают в реакции с кислородом, азотом, серой и другими неметаллами. Они могут образовывать оксиды, нитриды, сульфиды и другие соединения с различными элементами. Щелочноземельные металлы также могут образовывать соли с кислотами, что делает их важными реагентами в химической промышленности и в лабораторных исследованиях.
Способность щелочноземельных металлов образовывать соединения играет важную роль в их химических свойствах и применении в различных областях науки и технологии. Эти металлы могут быть использованы в производстве сплавов, керамических материалов, пищевых добавок и других продуктов. Их способность образовывать соединения также определяет их роль в биологических системах и влияние на окружающую среду.
Влияние на живые организмы и окружающую среду
Щелочноземельные металлы, включая бериллий, магний, кальций, стронций, барий и радий, могут оказывать как положительное, так и отрицательное влияние на живые организмы и окружающую среду.
Некоторые щелочноземельные металлы, например, кальций и магний, являются необходимыми элементами для жизнедеятельности организмов. Они входят в состав костей, зубов и мышц, участвуют в регуляции клеточных процессов и обеспечивают нормальное функционирование нервной системы.
Однако, при избыточном количестве этих металлов в организме человека или животного, они могут вызывать отрицательные последствия. Например, переизбыток кальция может привести к образованию камней в почках, а избыток магния может вызвать расстройство пищеварения.
Некоторые щелочноземельные металлы, такие как бериллий и радий, известны своей токсичностью. Контакт с ними или вдыхание их паров, пыли или газов может вызвать серьезные заболевания, такие как бериллиоз или радиационная болезнь.
Щелочноземельные металлы также оказывают влияние на окружающую среду. Например, их высокая растворимость в воде может приводить к загрязнению водоемов и питьевой воды. Выпуск щелочноземельных металлов в атмосферу может вызывать загрязнение воздуха и приводить к образованию кислотных осадков.
Однако, щелочноземельные металлы также находят применение в различных отраслях промышленности и науки. Например, бериллий используется при производстве сплавов и керамики, магний применяется в авиационной и автомобильной промышленности, а кальций используется в производстве строительных материалов.
- Кальций:
- Необходим для нормального формирования и функционирования костей и зубов
- Участвует в регуляции клеточных процессов
- Обеспечивает нормальное функционирование нервной системы
- Магний:
- Необходим для нормального функционирования мышц
- Участвует в регуляции сердечного ритма
- Способствует образованию энергии в организме
- Бериллий:
- Используется при производстве сплавов и керамики
- Радий:
- Известен своей высокой токсичностью и радиоактивностью
- Входит в состав радиоактивных источников
Вопрос-ответ:
Какие металлы относятся к щелочноземельным?
К щелочноземельным металлам относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Откуда происходит название «щелочноземельные» металлы?
Название «щелочноземельные» металлы происходит от их свойств образовывать оксиды и гидроксиды, которые имеют щелочную реакцию в растворе.
Какие свойства характерны для щелочноземельных металлов?
Щелочноземельные металлы обладают следующими свойствами: мягкость, низкую плотность, низкую температуру плавления, высокую химическую активность и способность образовывать ионы положительного заряда.
Каково значение щелочноземельных металлов в нашей жизни?
Щелочноземельные металлы имеют важное значение в нашей жизни. Например, магний используется в легких сплавах, строительстве, фармакологии и металлургии. Кальций необходим для образования костной ткани и нервной системы. Стронций применяется в атомной энергетике и в производстве красителей для стекла и керамики.
В чем причина высокой химической активности щелочноземельных металлов?
Причина высокой химической активности щелочноземельных металлов заключается в их низкой ионизационной энергии и большом радиусе иона. Это делает их легкодоступными для электронных реакций с другими элементами.
Что такое щелочноземельные металлы?
Щелочноземельные металлы — это группа химических элементов, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они являются химически активными металлами и имеют сходные свойства. Отличительной особенностью щелочноземельных металлов является их восприимчивость к окислению и образованию оксидных пленок на поверхности.