Количество вещества является одной из фундаментальных физических величин, имеющей важное значение в науке и технике. Это показатель, который используется для измерения объема вещества в химических реакциях и процессах. Величина количества вещества позволяет определить количество атомов, молекул или ионов, присутствующих в данном объекте или реакции.
Молюлюлярный мир полон разнообразия, и количественное измерение вещества позволяет нам получить представление о его составе и структуре. Один из способов измерения количества вещества — использование специальной единицы измерения, называемой молью.
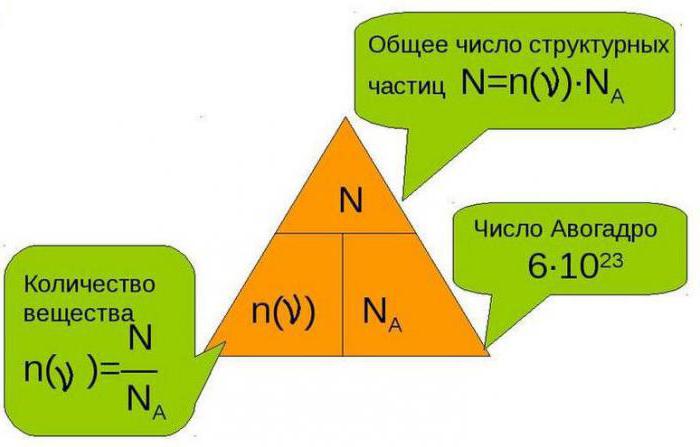
Моль (моль) — это особая физическая единица, которая определяется как количество вещества, содержащее столько элементарных объектов, сколько атомов содержится в 0,012 кг углерода-12 (это число известно как число Авогадро).
Определение понятия «количество вещества»
Моль — это стандартная единица измерения количества вещества и определяется следующим образом: одна моль содержит столько частиц (атомов, молекул и т.д.), сколько атомов содержится в 12 граммах изотопа углерода C-12.
Количество вещества позволяет измерять количество реактивов и продуктов химических реакций, а также производить точные расчеты стехиометрии.
Для удобства расчетов с использованием количества вещества в химии используется число Авогадро — это количество частиц (6,02214076 × 10^23 частиц) в одной моли вещества.
Таким образом, количество вещества является важным понятием в химии, позволяющим оперировать большими масштабами атомов, молекул и других частиц вещества для проведения точных расчетов и понимания химических процессов.
Что означает количество вещества
Количество вещества имеет огромное значение для понимания и описания химических реакций, так как позволяет определить точное соотношение между различными веществами в реакции. Это позволяет химикам оптимизировать условия реакции, контролировать степень превращения вещества и расчетно предсказывать результаты.
Количество вещества также позволяет определять концентрацию растворов, расчеты при проведении анализов и записывать балансовые уравнения химических реакций.
Важно отметить, что количеством вещества измеряем только количество вещества. Это не та же самая величина, что и масса. Масса вещества измеряется в граммах, а количество вещества — в молях.
Значение количества вещества в химии
Моль

Моль (обозначается молью или Моль) — это количество вещества, которое содержит столько элементарных единиц (атомов, ионов, молекул), сколько содержится в 0,012 кг углерода-12. Это число называется числом Авогадро и равно примерно 6,022 x 10^23.
Молярная масса
Молярная масса — это масса одной моли вещества. Она измеряется в граммах и вычисляется путем сложения атомных масс всех атомов в молекуле. Например, молярная масса воды (H2O) равна 18 г/моль (2 г за каждый атом водорода и 16 г за атом кислорода).
Знание количества вещества является важным при проведении химических реакций и расчетах. Оно позволяет определить количество реагентов, необходимых для процесса, и количество продукта, которое будет образовано.
Количество вещества также используется для выражения концентрации растворов (молярность) и для определения степени превращения вещества во время химической реакции.
Единица измерения количества вещества
Моль
Моль — это количество вещества, содержащее столько элементарных единиц, сколько атомов в 0,012 килограмма углерода-12. Таким образом, одна моль вещества содержит примерно 6,022 × 10^23 элементарных единиц и обозначается как Avogadro’s number (N).
Моль является основной единицей для измерения количества вещества и позволяет проводить точные расчеты и определения соотношений между различными веществами в реакциях.
Один моль вещества содержит такое же количество частиц, как и в одном моле любого другого вещества, независимо от его химической формулы. Например, один моль кислорода содержит 6,022 × 10^23 молекул кислорода, а один моль воды содержит 6,022 × 10^23 молекул воды.
Моль позволяет связать массу вещества с количеством его атомов или молекул. Масса одного моля вещества называется молярной массой и измеряется в граммах на моль (г/моль).
Применение
Единица измерения моль широко применяется в химии и физике для расчетов реакций, определения соотношений между веществами и изучения свойств веществ.
- В химических реакциях моли используются для установления соотношения между реагентами и продуктами, позволяя точно определить количество вещества, необходимого для проведения реакции.
- Молярная масса вещества используется для расчета массы, объема или концентрации вещества в реакциях или растворах.
- Моли также используются для определения количества атомов или молекул вещества. Например, известное количество вещества может быть использовано для определения числа частиц этого вещества.
В общем, моль является основным понятием химии и физики, позволяющим проводить точные расчеты и измерения вещества, и она играет важную роль в понимании и изучении различных научных дисциплин.
Что такое моль
Одна моль (1 моль) определена как количество вещества, содержащее столько элементарных единиц, сколько атомов содержится в 0,012 килограмма атомарного углерода (12C). Таким образом, количество атомов в одной моле равно числу Авогадро, приблизительно равному 6,022 × 10^23.
Использование моля позволяет облегчить работу с большими количествами вещества и решать задачи, связанные с расчетами химических реакций и соотношений между веществами. Например, зная количество вещества в молях, можно определить количество вещества в граммах или расчитать мольную массу вещества.
| Величина | Обозначение | Единица измерения |
|---|---|---|
| Количество вещества | n | моль |
Помимо количества вещества, моль также связана с другими величинами, такими как мольная масса, мольный объем и концентрация. Использование моля в химии является важным инструментом для изучения химических реакций, расчетов и прогнозирования результатов.
Моль в международной системе единиц
Моль является основной единицей измерения количества вещества и используется во многих физических и химических расчетах. В международной системе единиц, моль определена как количество вещества, которое содержит столько элементарных единиц (атомов, молекул, ионов и т.д.), сколько атомов содержится в 0,012 килограмма чистого изотопа углерода-12.
Моль — это строго определенное количество вещества. Например, одна моль атомов углерода-12 содержит столько же атомов, сколько и одна моль атомов любого другого элемента.
Использование моли позволяет устанавливать связь между макроскопическими и микроскопическими свойствами вещества. Также моль позволяет проводить точные расчеты в химических реакциях и определять количество вещества, необходимое для достижения определенной реакции или процесса.
Преобразование между молями и атомами
Атомы также используются для измерения количества вещества, особенно для элементов, у которых нет возможности группировать атомы в молекулы. Количество атомов вещества может быть выражено в терминах молярной массы элемента, где 1 моль содержит примерно 6,022 × 10^23 атома, это число называется числом Авогадро.
Преобразование между молями и атомами может быть достигнуто с помощью использования соотношения между числом атомов и числом молей. Например, для преобразования количества вещества из атомов в моли необходимо разделить количество атомов на число Авогадро (6,022 × 10^23).
Обратное преобразование — из молей в атомы — достигается путем умножения количества молей на число Авогадро. Это позволяет получить общее количество атомов в системе, основанное на известном количестве молей вещества.
Преобразование между молями и атомами является важным понятием в химии, поскольку позволяет установить связь между макроскопическими и микроскопическими характеристиками вещества. Также такое преобразование позволяет упростить расчеты и проводить сравнительные анализы различных веществ.
Применение молей в химических расчетах
Количество вещества, измеряемое в молях, позволяет установить отношения между различными химическими веществами, которые участвуют в реакции. Используя стехиометрические коэффициенты химического уравнения, можно определить соотношение между числом молей вещества и его массой.
Пример применения молей в химических расчетах:
Рассмотрим реакцию горения этилового спирта:
C2H5OH + 3O2 → 2CO2 + 3H2O
В данной реакции каждый молекула этилового спирта (C2H5OH) взаимодействует с тремя молекулами кислорода (O2), образуя две молекулы углекислого газа (CO2) и три молекулы воды (H2O). Если известно количество этилового спирта в молях, то с помощью стехиометрических коэффициентов можно определить количество образовавшихся продуктов.
Расчет массы вещества:
Если известно количество вещества в молях, то по известной молярной массе вещества можно вычислить его массу. Формула для расчета массы вещества:
масса = количество молей × молярная масса
Например, если известно, что в реакции участвует 2 моля этилового спирта (C2H5OH) и известна его молярная масса (46 г/моль), то масса этилового спирта можно посчитать следующим образом:
масса этилового спирта = 2 моля × 46 г/моль = 92 г
Таким образом, применение молей в химических расчетах позволяет определить количество вещества, устанавливать соотношения между реагентами и продуктами, а также вычислять массу вещества на основе его количества в молях.
Вопрос-ответ:
Что такое количество вещества и как оно измеряется?
Количество вещества — это физическая величина, которая характеризует количество вещества в системе. Единицей измерения количества вещества является моль (моль — это количество вещества, которое содержит столько же элементарных единиц, сколько атомов содержится в 0,012 кг изотопа углерода-12).
Какими еще единицами можно измерять количество вещества?
Кроме моля, количество вещества можно измерять также в атомах, молекулах, ионах и других единицах, которые связаны с числом частиц вещества.
Зачем вводить еще одну единицу измерения, если уже есть граммы и килограммы?
Введение единицы измерения «моль» позволяет более точно оценивать и сравнивать количество вещества, не зависимо от его веса или массы. Моль дает возможность работать с числами, представляющими количество частиц вещества, что является особенно важным в молекулярной и атомной физике.
Как можно представить количество вещества визуально?
Количество вещества можно представить в виде определенного числа частиц, например, молекул или атомов. Также можно использовать макроскопические представления, например, эквивалентное количество вещества может быть изображено в виде вещества в определенном объеме или массе.
Как связаны масса и количество вещества?
Масса и количество вещества взаимосвязаны: масса вещества пропорциональна его количеству. То есть, увеличение количества вещества приводит к увеличению его массы, а уменьшение количества вещества — к уменьшению массы.
Что такое количество вещества и как его измеряют?
Количество вещества — это физическая величина, которая описывает количество атомов, молекул, ионов или других элементов, составляющих данную вещество. Оно измеряется в молях.