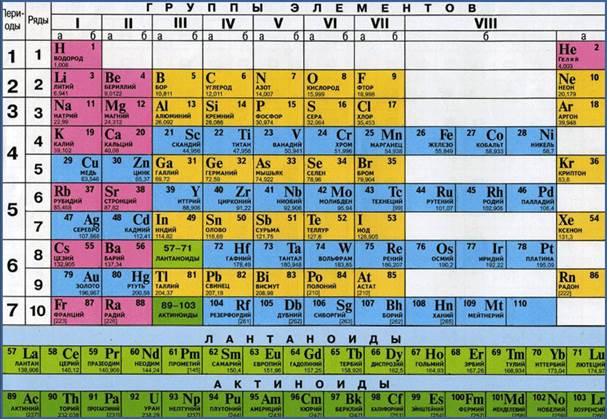
Относительная атомная и молекулярная масса — это понятия, используемые в химии для измерения массы атомов и молекул, относительно массы атома углерода-12 (12C), которой присваивается значение 12.
Относительная атомная масса выражается в атомных массовых единицах (аму) и отображает отношение массы атома данного элемента к массе атома углерода-12. Например, если атом водорода имеет относительную атомную массу 1, то это означает, что атом водорода в 12 раз легче атома углерода-12.
Относительная молекулярная масса, также известная как молекулярный вес, используется для измерения массы молекулы. Она рассчитывается путем сложения относительных атомных масс всех атомов в молекуле. Например, молекула воды (H2O) состоит из двух атомов водорода и одного атома кислорода. Поэтому относительная молекулярная масса воды равняется сумме относительных атомных масс кислорода (16 аму) и двух атомов водорода (2 аму), то есть 18 аму.
Что такое относительная атомная масса
Относительная атомная масса вычисляется путем сравнения массы атома данного элемента с массой одной двенадцатой части атома углерода-12. Атом углерода-12 выбран в качестве стандарта, так как его атомная масса считается примерно равной единице. Относительная атомная масса обычно выражается в атомных единицах (указывается символ «u»).
Относительная атомная масса позволяет установить пропорциональное соотношение между количеством атомов различных элементов в веществах и их массами. Например, если вещество содержит один атом водорода и один атом кислорода, то его относительная атомная масса будет равна сумме относительных атомных масс атома водорода и атома кислорода. Зная относительную атомную массу элемента и его количество в веществе, можно вычислить относительную молекулярную массу формулы этого вещества.
Определение и основные понятия
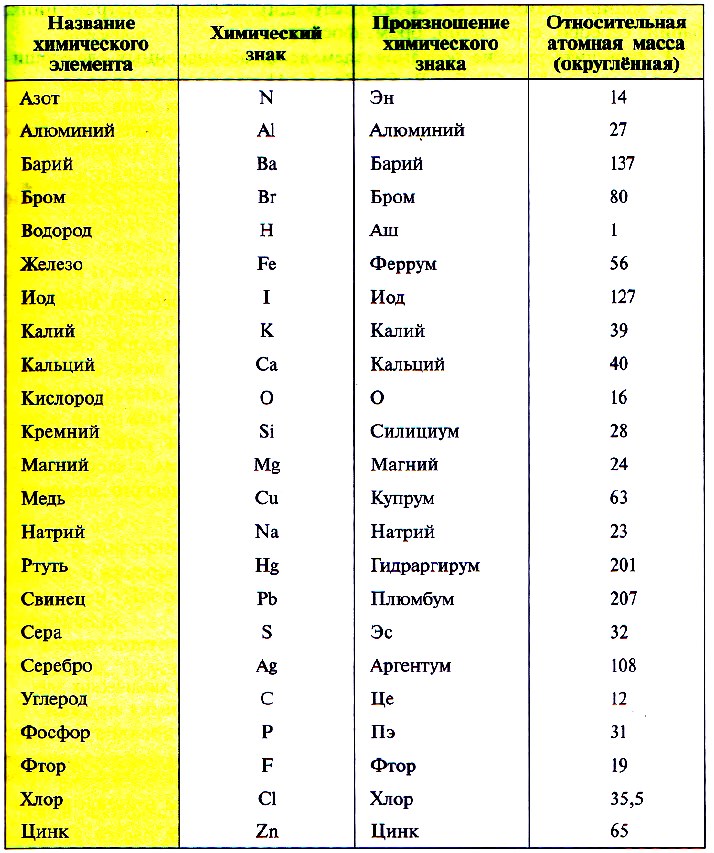
Относительная молекулярная масса — это сумма относительных атомных масс атомов, образующих молекулу химического вещества. Она также измеряется в атомных единицах массы (а.е.м.) и является безразмерной величиной.
Относительные атомные и молекулярные массы используются для определения количества вещества в химических реакциях и расчетов в химии. Они позволяют установить массовые отношения между различными элементами и соединениями, а также проводить сравнение масс разных веществ.
Относительная атомная и молекулярная массы являются важными понятиями в химии, и их понимание необходимо для правильного изучения и применения химических законов и принципов.
Формула расчета
Относительная атомная масса (массовое число) и относительная молекулярная масса вычисляются по формуле:
Относительная атомная масса (массовое число):
М = m/n
где M — относительная атомная масса (массовое число),
m — масса атома элемента в атомных единицах (универсальной атомной массовой единице),
n — масса 1/12 массы атома углерода-12 в атомных единицах (универсальной атомной массовой единице).
Относительная молекулярная масса:
Ммол = M1 + M2 + M3 + … + Mn
где Ммол — относительная молекулярная масса,
M1, M2, M3, …, Mn — относительные атомные массы (массовые числа) атомов, входящих в молекулу.
Таким образом, относительная атомная масса и относительная молекулярная масса позволяют определить массу атома или молекулы относительно массы углерода-12, принятой равной 12 единицам.
Примеры использования
1. Химические расчеты:
Относительная атомная масса и относительная молекулярная масса используются для проведения различных химических расчетов. Например, при расчете количества вещества или массы реагента, необходимого для проведения реакции, используются значения относительных масс атомов и молекул.
2. Определение состава вещества:
Зная относительные массы атомов и молекул вещества, можно определить его состав. Это особенно полезно при изучении сложных органических соединений или анализе проб материалов.
3. Определение молекулярной формулы:
Зная относительную молекулярную массу соединения и его состав, можно определить его молекулярную формулу. Это позволяет установить точный состав и структуру соединения.
4. Исследование физико-химических свойств:
Использование относительной атомной массы и относительной молекулярной массы позволяет изучать и предсказывать физико-химические свойства вещества, такие как плотность, температура плавления и кипения, растворимость и другие.
Важно понимать, что относительная атомная масса и относительная молекулярная масса необходимы для понимания и описания многих процессов и свойств вещества, и их использование имеет большое значение в химической науке и промышленности.
Что такое относительная молекулярная масса
Относительная молекулярная масса вычисляется путем сложения относительных атомных масс атомов, образующих молекулу соединения. Каждому атому присваивается относительная атомная масса, которая определена в таблице химических элементов.
Относительная молекулярная масса позволяет проводить расчеты связанные с количеством вещества, массой и стехиометрией химических реакций. Она используется для определения молекулярных весов различных химических соединений и помогает устанавливать количественные соотношения между веществами.
Определение и основные понятия
Относительная атомная масса
Относительная атомная масса обозначается символом «A» и является числом, указывающим, сколько раз атом данного элемента тяжелее 1/12 массы атома углерода-12. Она используется для выражения массы атомов относительно эталонного атома и измеряется в атомных единицах массы (аму).
Относительная атомная масса рассчитывается путем сравнения массы атома данного элемента с массой атома углерода-12. Например, относительная атомная масса водорода равна приблизительно 1,00784, что означает, что атом водорода примерно в 1,00784 раза легче атома углерода-12.
Относительная молекулярная масса
Относительная молекулярная масса обозначается символом «M» и используется для измерения массы молекулы относительно единицы массы. Она представляет сумму относительных атомных масс всех атомов, составляющих молекулу.
Относительная молекулярная масса дает информацию о том, сколько раз молекула данного вещества тяжелее 1/12 массы атома углерода-12. Например, относительная молекулярная масса воды (H2O) равна приблизительно 18,0153, что означает, что молекула воды примерно в 18,0153 раза тяжелее атома углерода-12.
Формула расчета
Относительная атомная масса (А) и относительная молекулярная масса (М) вычисляются с помощью следующей формулы:
- А = масса одного атома / 1/12 массы атома углерода-12
- М = масса всех атомов в молекуле / 1/12 массы атома углерода-12
Для расчета относительной атомной массы необходимо знать массу одного атома выбранного элемента и массу атома углерода-12. Для расчета относительной молекулярной массы необходимо знать массу всех атомов в молекуле выбранного соединения и массу атома углерода-12.
Примеры использования
Относительная атомная масса и относительная молекулярная масса широко используются в химии для расчетов и определения химических свойств веществ.
Рассмотрим примеры использования:
| Пример | Описание |
|---|---|
| 1 | Расчет массы атома или молекулы |
| 2 | Определение стехиометрических коэффициентов в химических реакциях |
| 3 | Расчет массового процента элементов в соединении |
| 4 | Определение молярной массы вещества |
| 5 | Идентификация веществ по их массовым отношениям |
Это лишь некоторые примеры использования относительной атомной массы и относительной молекулярной массы. Эти показатели являются важными инструментами для понимания состава вещества и проведения химических расчетов.
Вопрос-ответ:
Что такое относительная атомная масса?
Относительная атомная масса — это масса одного атома элемента, выраженная в относительных единицах относительной атомной массы.
Как вычисляется относительная атомная масса?
Относительная атомная масса вычисляется путем усреднения масс атомов всех изотопов элемента, пропорционально их относительным содержаниям.
Что такое относительная молекулярная масса?
Относительная молекулярная масса — это масса одной молекулы вещества, выраженная в относительных единицах относительной атомной массы.
Как связаны относительная атомная масса и относительная молекулярная масса?
Относительная атомная масса и относительная молекулярная масса связаны путем суммирования масс атомов в составе молекулы с учетом их относительных количеств.