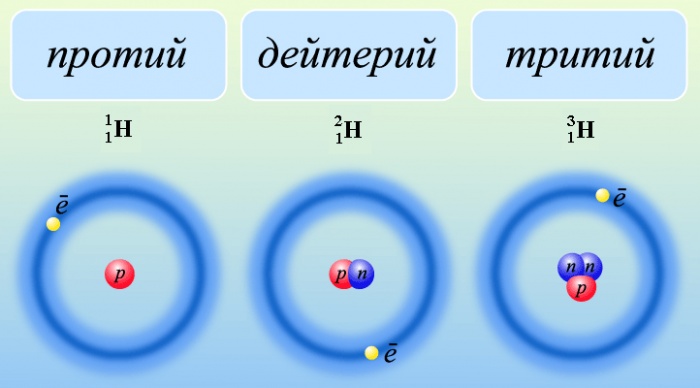
Изотопами называются атомы одного и того же химического элемента, имеющие одинаковое количество протонов в ядре, но различное количество нейтронов. Нейтроны могут быть различными по своему количеству, что приводит к возникновению различных изотопов. Изотопы химического элемента отличаются массовым числом, которое равно сумме числа протонов и нейтронов в ядре атома.
Изотопы являются фундаментальными понятиями в ядерной физике и химии. Их наличие позволяет детально изучать различные процессы, связанные с атомными ядрами. Каждый изотоп имеет свои уникальные свойства и может использоваться для различных целей.
Изотопы играют важную роль в медицине, энергетике, археологии и других областях науки и техники. Например, изотопы используются в радиоактивных препаратах в медицине для диагностики и лечения определенных заболеваний. Также изотопы являются основными компонентами ядерных реакторов, где происходит расщепление атомов и выделение энергии. Археологи используют изотопы для определения возраста артефактов и исторических объектов.
Изотопы и их свойства
Изотопами называются атомы, имеющие одинаковое количество протонов в ядре, но различное количество нейтронов. Изотопы одного и того же химического элемента имеют одинаковое расположение в периодической системе элементов и одинаковое количество электронов в электронных оболочках, но отличаются массой.
Свойства изотопов определяются их массой и структурой ядра. Различное количество нейтронов в ядре влияет на стабильность атома. Некоторые изотопы являются радиоактивными и нестабильными, что делает их подверженными распаду. За счет этого, радиоактивные изотопы находят применение в научных и медицинских исследованиях, в том числе в радиологии и радиотерапии. Нестабильные изотопы могут быть использованы для датирования геологических и археологических образцов.
Изотопы также могут иметь различные изотопные формы, которые по-разному обозначаются. Например, углерод может иметь три изотопных формы: углерод-12, углерод-13 и углерод-14. Изотопы обычно обозначаются символом элемента, за которым следует суммарное количество протонов и нейтронов в ядре. Например, для углерода-12 обозначение будет C-12.
Свойства изотопов могут быть использованы для различных приложений. Например, радиоактивные изотопы используются в медицине для диагностики и лечения заболеваний, в археологии для датирования старинных предметов, в промышленности для контроля процессов и качества продукции.
Определение изотопов и их роль
Изотопами называются атомы одного и того же химического элемента, имеющие одинаковое количество протонов в ядре, но разное количество нейтронов. Таким образом, изотопы отличаются от друг друга массовым числом, которое равно сумме протонов и нейтронов в ядре.
Изотопы химических элементов могут быть стабильными или нестабильными (радиоактивными). Стабильные изотопы остаются неизменными во времени и не подвержены распаду, в то время как радиоактивные изотопы подвержены радиоактивному распаду со временем.
Роль изотопов в науке
Изотопы играют важную роль во множестве научных областей. Одна из таких областей — геология, где изотопы используются для определения возраста горных пород и артефактов. Также изотопы применяются в археологии для определения возраста древних артефактов.
В медицине изотопы используются в диагностике и лечении различных заболеваний, включая рак. Радиоактивные изотопы могут использоваться для облучения опухолей и уничтожения раковых клеток внутри организма.
Изотопы также играют важную роль в атомной энергетике. Некоторые изотопы, например уран и плутоний, используются в ядерных реакторах для производства электроэнергии. Изотопы также используются в ядерных вооружениях.
Примеры изотопов и их особенности

Примеры стабильных изотопов:
- Углерод-12 (12С): Самый распространенный изотоп углерода. Он имеет 6 протонов и 6 нейтронов в своем ядре.
- Углерод-13 (13С): Имеет 6 протонов и 7 нейтронов в своем ядре. Используется в анализе изотопного состава проб.
- Углерод-14 (14С): Имеет 6 протонов и 8 нейтронов в своем ядре. Широко используется в радиоуглеродном датировании археологических находок.
Примеры радиоактивных изотопов:
- Уран-235 (235U): Имеет 92 протона и 143 нейтрона в своем ядре. Используется в ядерной энергетике и при производстве ядерного оружия.
- Радий-226 (226Ra): Имеет 88 протонов и 138 нейтронов в своем ядре. Имеет свойство испускать альфа-частицы и использовался в медицине в прошлом.
- Цезий-137 (137Cs): Имеет 55 протонов и 82 нейтрона в своем ядре. Образуется в ядерных реакторах и может вызывать радиационное заражение.
Это лишь несколько примеров из множества известных изотопов. Изучение свойств и использование изотопов имеют большое значение в различных областях науки, технологии и медицине.
Способы получения изотопов
Существует несколько способов получения изотопов.
1. Разделение изотопов методом фракционирования
Один из методов получения изотопов — это разделение изотопов методом фракционирования. При этом методе используется разность в физических свойствах различных изотопов. Изначально, смесь изотопов подвергается действию различных физических процессов, таких как диффузия, испарение или конденсация, диффузионный отделитель или центрифугирование. Это позволяет разделить изотопы и получить изотоп высокой чистоты.
2. Использование ядерных реакций
Другим способом получения изотопов является использование ядерных реакций. При этом способе используется реакция, в которой участвуют ядерные частицы. Путем бомбардировки атомных ядер потоком нейтронов или другими частицами, происходит превращение одного изотопа в другой. Этот метод широко применяется в ядерной энергетике и в медицинских исследованиях.
Таким образом, существуют различные способы получения изотопов, каждый из которых имеет свои преимущества и недостатки и используется в различных областях науки, технологии и медицины.
Применение изотопов в науке и промышленности

Изотопами называются атомы одного и того же элемента, у которых число нейтронов в ядре отличается. Изотопы широко применяются в науке и промышленности благодаря своим уникальным свойствам и возможностям.
Радиоактивные изотопы в науке
Радиоактивные изотопы используются в науке в различных областях исследований. Они позволяют проводить многочисленные эксперименты и измерения, необходимые для понимания законов природы и развития новых технологий.
Например, радиоактивные изотопы используются в медицине для диагностики болезней и раковых опухолей, а также в радиотерапии. Они помогают выявить наличие определенных веществ в организме и отслеживать их перемещение.
В физике и астрономии радиоактивные изотопы помогают исследовать свойства материи, состав галактик и происхождение Вселенной. Благодаря ним ученые могут изучать структуру атомов и молекул, проводить эксперименты с ядерной энергией и многое другое.
Изотопы в промышленности
Изотопы также находят широкое применение в промышленности. Они используются для создания новых материалов и технологий, а также в процессе контроля качества и безопасности продукции.
Например, стабильные изотопы используются для маркировки и отслеживания продуктов питания, включая мясо, фрукты и овощи. Это позволяет определить их происхождение, проверить наличие пестицидов или других вредных веществ.
Радиоизотопы применяются для неразрушающего контроля материалов, обнаружения утечек и измерения толщины слоев при производстве и ремонте трубопроводов, реакторов и других конструкций.
Также изотопы используются в процессе добычи нефти и газа, при производстве лекарственных препаратов, в электронике, сельском хозяйстве и других отраслях промышленности.
Применение изотопов в науке и промышленности продолжает расширяться, что открывает новые возможности для исследований и развития инновационных технологий.
Распределение изотопов в природе
Изотопами называются атомы одного и того же элемента, отличающиеся по числу нейтронов в атомном ядре. В природе существует множество различных изотопов разных элементов. Распределение этих изотопов в природе может быть разным и зависит от различных факторов.
Распределение изотопов в природе определяется прежде всего процессами образования и разрушения атомных ядер. В ходе этих процессов могут происходить различные ядерные реакции, в результате которых образуются новые изотопы или разрушаются существующие. Также влияние на распределение изотопов оказывают факторы, связанные с окружающей средой, такие как геологические процессы, метеорологические условия, биологические процессы и др.
При изучении распределения изотопов в природе важным является понятие изотопного состава. Изотопный состав определяется количественным соотношением изотопов данного элемента. Обычно изотопный состав выражается в виде изотопных фракций или изотопных отношений, которые показывают, сколько процентов составляет каждый из изотопов в общей массе атомов этого элемента.
Распределение изотопов в природе может иметь различную степень вариации в зависимости от элемента и конкретного изотопа. Например, некоторые элементы имеют только один стабильный изотоп (например, кислород-16), в то время как другие элементы имеют несколько стабильных изотопов (например, углерод-12, углерод-13 и углерод-14).
Изотопное составляет широкое применение в различных научных и практических областях. Например, по изотопному составу можно определить возраст геологических образований, изучить процессы геологической и космической эволюции, расследовать биологические процессы, исследовать пищевые и питьевые продукты, анализировать окружающую среду и многое другое.
Радиоактивность и стабильность изотопов
Изотопами называются атомы одного и того же химического элемента, которые отличаются числом нейтронов в ядре. Само понятие изотопов говорит о том, что такие атомы имеют одинаковый номер протонов, но могут иметь разное количество нейтронов.
Различные изотопы одного и того же элемента могут быть стабильными или радиоактивными. Стабильные изотопы не подвергаются спонтанным ядерным превращениям и обладают химическими свойствами, свойственными данному элементу. Такие изотопы могут использоваться в различных научных и практических целях, включая исследования в области атомной физики, радиоактивного датирования и экологии.
С другой стороны, радиоактивные изотопы характеризуются тем, что они подвержены спонтанным ядерным превращениям. В результате этих превращений происходит излучение альфа-частиц, бета-частиц, гамма-лучей и других видов радиации. Радиоактивность может иметь как природное, так и искусственное происхождение. Радиоактивные изотопы широко используются в медицине (например, в диагностике и лечении онкологических заболеваний), промышленности (например, в контроле качества и исследованиях материалов) и науке (например, в процессе исследования и изучения ядерных реакций).
Безопасность и регулирование использования изотопов
Использование изотопов в настоящее время тщательно регулируется с целью обеспечения безопасности процессов, связанных с их применением. Правильное использование изотопов подразумевает соблюдение строгих норм и правил ведения работ с радиоактивными веществами.
Безопасность использования изотопов
Для обеспечения безопасности использования изотопов необходимо соблюдение следующих мер:
- Работы с изотопами должны проводиться в специальных помещениях, оборудованных радиационными экранами и системами вентиляции, защищенными от несанкционированного доступа.
- Персонал, работающий с изотопами, должен быть прошедшим специальную подготовку и иметь соответствующую лицензию.
- Используемые изотопы должны быть храниться в специальных контейнерах и утилизироваться согласно действующим нормам.
- Необходимо регулярно контролировать уровень радиоактивного загрязнения в помещениях и на рабочих местах.
- Предусматривается использование индивидуальных средств защиты, таких как защитные очки, перчатки и халаты.
Регулирование использования изотопов
Использование изотопов регулируется различными организациями и учреждениями, занимающимися ядерной безопасностью и контролем. В каждой стране существуют свои нормативно-правовые акты, регламентирующие процедуры работы с изотопами и требования к их использованию.
Основные меры регулирования использования изотопов включают в себя:
- Лицензирование деятельности, связанной с использованием изотопов.
- Разработка и внедрение стандартов и технических регламентов, касающихся безопасности применения изотопов.
- Обязательная сертификация оборудования и материалов, предназначенных для работы с изотопами.
- Регулярная проверка и аттестация специалистов, работающих с радиоактивными веществами.
- Контроль и мониторинг радиоактивного загрязнения в окружающей среде.
Перспективы исследования и развития изотопов
Исследование и развитие изотопов имеет огромный потенциал во многих областях науки и технологий. Обозначим несколько перспективных направлений:
- Медицина и фармацевтика. Изотопы широко используются в медицинских исследованиях и диагностике заболеваний. Также разработка новых изотопных препаратов позволяет существенно улучшить лечение многих заболеваний.
- Энергетика. Изотопы играют важную роль в атомной энергетике. Разработка новых изотопов может привести к созданию более эффективных и безопасных ядерных реакторов, а также к повышению уровня запасов ядерного топлива.
- Биология. Изотопы используются в биологических исследованиях для отслеживания химических процессов в организмах. Это позволяет лучше понять различные биологические процессы и разработать новые методы лечения болезней.
- Геология и экология. Изотопы помогают ученым изучать процессы, происходящие в природе. Они позволяют определить возраст горных пород, расследовать изменения климата и осуществлять контроль за загрязнением окружающей среды.
- Науки о Земле. Изотопы используются в геохимии и геофизике для изучения процессов, происходящих в земной коре и мантии. Это позволяет ученым лучше понять структуру нашей планеты и предсказывать ее геологические изменения.
Уровень исследования и развития изотопов постоянно растет, и в будущем можно ожидать появления новых инновационных технологий и применений в различных отраслях науки и техники.
Вопрос-ответ:
Что такое изотопы?
Изотопами называются атомы одного и того же химического элемента, у которых различается число нейтронов в ядре. Это приводит к различным массовым числам изотопов, но при этом химические свойства элемента остаются неизменными.
Почему у атомов изотопов одного элемента может отличаться число нейтронов, но не отличаются химические свойства?
Химические свойства элемента определяются его электронной структурой, а не числом нейтронов в ядре. Электроны, находящиеся на внешнем энергетическом уровне, участвуют в химических реакциях, а число нейтронов не влияет на эти процессы.
Какие ещё различия между изотопами, кроме числа нейтронов?
Основное различие между изотопами заключается в их массе. Также, у изотопов могут быть различные периоды полураспада, что означает, что они распадаются на другие элементы с различной скоростью.
Может ли наличие определенного изотопа быть опасным для человека?
Некоторые изотопы могут быть опасными для человека из-за их радиоактивности и способности повреждать клетки и генетический материал. Использование радиоактивных изотопов должно выполняться в строго контролируемых условиях и соблюдение соответствующих мер предосторожности.
Какие применения имеют изотопы в науке и технологиях?
Изотопы находят широкое применение в различных областях, таких как медицина (изотопы используются в диагностике и лечении заболеваний), энергетика (ядерная энергетика), археология (датировка органических материалов), а также в геологии, пищевой промышленности и др.
Что такое изотопы?
Изотопами называются атомы одного и того же элемента, имеющие одинаковое количество протонов, но разное количество нейтронов в ядре.