В химии существует множество различных реакций, каждая из которых имеет свои особенности и принципы. Одной из таких реакций является обратная реакция этерификации, которая получила свое название благодаря своему взаимодействию с эфирами. Причем важно отметить, что обратная реакция этерификации также обладает некоторыми уникальными свойствами, которые необходимо изучать и учитывать при проведении химических экспериментов.
Обратная реакция этерификации представляет собой обратный процесс к этерификации — реакции, в результате которой образуется эфир. В обратной реакции этерификации эфир разлагается на соответствующий спирт и соответствующую кислоту. Таким образом, можно сказать, что эта реакция является неким обратным преобразованием, которое восстанавливает исходные компоненты.
Важно отметить, что обратная реакция этерификации в значительной степени зависит от условий, в которых она происходит. Факторы, такие как температура, давление, катализаторы и другие, могут оказывать существенное влияние на скорость и направленность обратной реакции этерификации. Поэтому при проведении экспериментов необходимо быть внимательными и контролировать все условия, чтобы получить желаемый результат.
Определение реакции и этерификации
Этерификация – это реакция, в результате которой образуется эфир. Эфир – это органическое соединение, содержащее атом кислорода между двумя алкильными остатками или ароматическим ядром и алкильным остатком.
Этеры широко применяются в химической и фармацевтической промышленности как растворители, а также как основа для синтеза других соединений. Этерификация может происходить с участием различных кислот и алкоголей. Популярным примером этерификации является реакция между карбоновым кислородом и алкоголем, в результате которой образуется эфир и молекула воды.
Признаки реакции:
- Изменение химической природы вещества: при реакции исходные вещества претерпевают изменение, образуя новые соединения.
- Изменение энергетического состояния: реакции могут сопровождаться выделением или поглощением энергии в виде тепла, света или электричества.
- Изменение физических свойств вещества: реакции могут приводить к изменению цвета, запаха, температуры, плотности и других физических характеристик вещества.
- Протекание с определенной скоростью: реакции могут протекать со скоростью, зависящей от условий, таких как температура, концентрация реагентов и наличие катализаторов.
Основные типы реакций:
- Синтез: при синтезе два или более вещества сливаются в одно новое вещество.
- Распад: при распаде одно вещество разлагается на два или более меньших вещества.
- Замещение: при замещении один атом или группа атомов замещаются другими атомами или группами атомов.
- Окисление-восстановление: при окислении атомы вещества теряют электроны, а при восстановлении они приобретают электроны.
- Кислотно-щелочная: при этой реакции кислота и щелочь образуют соль и воду.
Понимание реакций и механизмов этерификации позволяет химикам и исследователям разрабатывать новые соединения и материалы, улучшать существующие процессы и создавать новые технологии в различных сферах науки и промышленности.
Основные принципы реакции обратной реакции
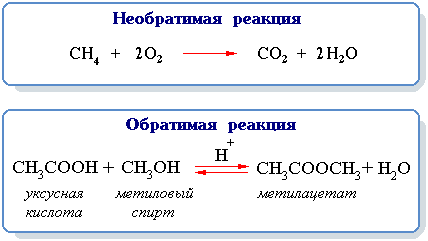
Основные принципы реакции обратной реакции включают следующее:
- Закон действующих масс. Согласно этому закону, скорость обратной реакции пропорциональна концентрации продуктов и пропорциональна коэффициенту равновесия реакции. Если обратная реакция идет медленнее исходной, то система будет стремиться достичь равновесия.
- Равновесие реакции. Обратная реакция происходит в равновесной системе, когда скорости прямой и обратной реакций равны. В равновесной реакции концентрации продуктов и исходных веществ остаются постоянными.
- Влияние температуры. Изменение температуры может изменить скорость обратной реакции. Повышение температуры может способствовать увеличению скорости обратной реакции, тогда как ее понижение может привести к замедлению реакции.
- Катализаторы. Катализаторы могут повысить скорость обратной реакции, ускоряя процесс превращения продуктов в исходные вещества. Катализаторы не используются полностью в ходе реакции и могут быть использованы многократно.
Основные принципы реакции обратной реакции играют важную роль в понимании химических реакций и разработке процессов синтеза различных веществ.
Эквилибриум в реакции обратной реакции
Реакция обратной реакции может протекать необходимое количество времени, прежде чем достигнет равновесия, то есть эквилибриума. Эквилибриум – это состояние системы, когда скорость прямой реакции равна скорости обратной реакции. На этом этапе концентрации продуктов и реагентов остаются в постоянном состоянии, но процессы превращения продолжаются. При этом реакция обратной реакции может описываться с помощью равновесной константы K, которая выражается через концентрации реагентов и продуктов данной реакции.
Для примера можно рассмотреть реакцию обратной реакции этерификации спирта метанола и кислоты уксусной:
| Реагенты | Продукты |
|---|---|
| Метанол (спирт) | Уксусная кислота |
| Уксусная кислота | Метанол (спирт) |
Концентрации реагентов и продуктов в данной реакции могут быть представлены следующим образом:
[Метанол] + [Уксусная кислота] → [Эфир] + [Вода]
[Эфир] + [Вода] ← [Метанол] + [Уксусная кислота]
Реакция обратной реакции этерификации является обратимой, и в зависимости от условий может протекать в ту или другую сторону. Если в систему добавляют больше реагентов или удаляют некоторые продукты, равновесие смещается в сторону образования эфиров, в случае с реагентами, или в сторону распада эфиров, в случае с продуктами.
Таким образом, эквилибриум в реакции обратной реакции является динамическим состоянием системы, при котором происходит постоянное превращение реагентов и продуктов реакции. Равновесная константа K при этом описывает соотношение между концентрациями реагентов и продуктов при достижении равновесия.
Константа равновесия и факторы, влияющие на обратную реакцию
Константа равновесия зависит от температуры и условий реакции. Факторы, влияющие на обратную реакцию этерификации, могут быть следующими:
- Температура: повышение температуры обычно ускоряет обратную реакцию, так как с увеличением температуры увеличивается энергия молекул и скорость их движения.
- Концентрация реагентов: увеличение концентрации реагентов может повысить скорость обратной реакции, так как большее количество реагентов увеличивает вероятность их взаимодействия.
- Давление: влияние давления на обратную реакцию этерификации зависит от реометрии системы. Если в системе присутствуют газы, повышение давления может увеличить концентрацию газовых компонентов и, следовательно, ускорить обратную реакцию.
- Катализаторы: некоторые вещества, называемые катализаторами, могут ускорять обратную реакцию этерификации, уменьшая энергию активации или предоставляя альтернативные пути реакции.
Знание константы равновесия и факторов, влияющих на обратную реакцию обратной реакции, позволяет контролировать ход и скорость этерификации и применять оптимальные условия для получения желаемых продуктов.
Термодинамика и кинетика реакции обратной реакции
Термодинамика реакции обратной реакции связана с энергией, которая свободна или поглощается в процессе. В зависимости от условий температуры и давления, реакция может быть эндотермической или экзотермической. Термодинамически управляемая обратная реакция происходит, когда изменение свободной энергии отрицательно, что означает, что процесс более благоприятен при обратных условиях.
Кинетика реакции обратной реакции определяет скорость, с которой происходит обратная реакция. Эта скорость может быть зависимой от концентрации реагентов и присутствия катализаторов. Кинетически управляемая обратная реакция может происходить при определенных условиях, даже если она термодинамически неблагоприятна.
Понимание термодинамики и кинетики реакции обратной реакции позволяет контролировать процессы обратных реакций и оптимизировать их в химических и биологических системах. Такие процессы имеют широкое применение в промышленности и научных исследованиях, включая синтез органических соединений, производство материалов и лекарственных веществ.
В итоге, термодинамика и кинетика реакции обратной реакции взаимосвязаны и позволяют понять и контролировать протекание реакций в обратную сторону в различных системах.
Примеры реакции обратной реакции в химии
Пример 1: Диссоциация воды
Вода образует равновесную реакцию с обратной реакцией, которая называется диссоциацией воды. Вода может проявлять свойства кислоты и основания, и при этом происходит образование ионов гидрония (H3O+) и гидроксидных (OH—) ионов. Эта реакция обратной реакции может быть представлена следующим образом:
| H2O | ⇌ | H3O+ | + OH— |
|---|
Обратная реакция представляет собой реагенты (H3O+ и OH—) взаимодействующие, чтобы образовать воду.
Пример 2: Гидролиз соли
Гидролиз соли — это реакция, когда соль реагирует с водой и образуется кислота и основание. Эта обратная реакция происходит в результате разделения ионов соли на ионы кислоты и основания. Например, гидролиз соли с Аn- и Вm+ ионами можно представить следующим образом:
| AnBm | + H2O | ⇌ | an- | + bm+ |
|---|
Обратная реакция происходит при реагировании ионов кислоты (an-) и ионов основания (bm+) для образования соли AnBm.
Примеры реакций обратной реакции в химии представляют собой важные процессы, позволяющие установить равновесие и понять механизмы различных химических реакций.
Практическое применение реакции обратной реакции
Эфиры широко используются в различных отраслях промышленности и быта. Они являются важными растворителями для множества химических веществ. Эфиры также используются в фармацевтической промышленности для создания различных лекарственных препаратов.
Реакция обратной реакции может быть использована для синтеза эфиров из соответствующих кислот и спиртов. Высокая конверсия и выборка этой реакции делает ее привлекательной для промышленного масштабирования.
Одним из важных применений реакции обратной реакции является синтез эфирного масла. Многие эфирные масла широко используются в парфюмерной и косметической промышленности. Реакция обратной реакции позволяет эфирное масло быть полученным из соответствующих кислот и спиртов, что делает процесс синтеза более эффективным и экономически выгодным.
Кроме того, реакция обратной реакции может быть использована для синтеза полиэфиров. Полиэфиры широко используются в полимерной промышленности для создания различных материалов и изделий. Реакция обратной реакции позволяет получить высокомолекулярные эфирные полимеры, которые обладают уникальными физическими и химическими свойствами.
Вопрос-ответ:
Вопрос
Как называется обратная реакция этерификации?
Вопрос
Что происходит при обратной реакции этерификации?
Вопрос
Какие вещества образуются при обратной реакции этерификации?
Вопрос
Какие условия необходимы для протекания обратной реакции этерификации?