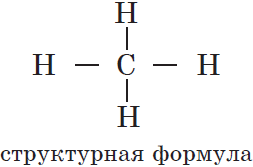
Молекулярные и структурные формулы органических соединений являются основными инструментами в органической химии. Они помогают нам понять и представить трехмерную структуру атомов и связей внутри молекулы. Прежде чем мы рассмотрим кратность ковалентной связи, давайте сначала разберемся с понятием ковалентной связи и ее особенностями.
Ковалентная связь — это связь между атомами, в которой электроны внешней оболочки атомов образуют общую оболочку. Электроны внешних оболочек атомов могут быть разделены на общие электронные пары, которые находятся между связанными атомами. Эти электронные пары обеспечивают связывание атомов в молекуле.
Кратность ковалентной связи в молекуле определяет, сколько электронных пар общих связей участвует в образовании связей между атомами. Для простых органических соединений, таких как метан (CH4), эта кратность равна одному, так как каждый атом углерода образует только одну связь с атомами водорода, и каждая связь образуется за счет одной общей электронной пары.
Кратность ковалентной связи
Ковалентная связь основана на взаимодействии электронов валентных оболочек атомов. Она может иметь разную кратность, которая определяется числом общих электронных пар между атомами.
Кратность ковалентной связи определяет, сколько электронных пар образует связь между атомами. Существуют тривиальные связи, такие как одинарная (1) и двойная (2) связи, а также более сложные связи, такие как тройная (3) и деликатная связь.
Одинарная связь представляет собой две общие электронные пары между двумя атомами, что обеспечивает наиболее стабильную конфигурацию. Ее можно представить в виде одного электронного отрезка между атомами.
Двойная связь состоит из двух общих электронных пар, которые обеспечивают более тесное взаимодействие между атомами и более сильную связь. Она представляется в виде двух электронных отрезков между атомами.
Тройная связь состоит из трех общих электронных пар, что обеспечивает еще более тесное и сильное взаимодействие между атомами. Она представляется в виде трех электронных отрезков между атомами.
Деликатная связь, или ароматическая связь, является особой формой связи, которая возникает в ароматических соединениях, таких как бензол. Она основана на особом распределении электронной плотности и обладает высокой степенью стабильности.
Кратность ковалентной связи влияет на физические и химические свойства органических соединений. Она может определять их реакционную способность, степень насыщенности и температуру кипения. Поэтому изучение кратности ковалентной связи имеет важное значение для понимания и использования органических соединений.
| Кратность связи | Число общих электронных пар | Примеры |
|---|---|---|
| Одинарная (1) | 2 | CH4 (метан) |
| Двойная (2) | 4 | O2 (кислород), CO2 (углекислый газ) |
| Тройная (3) | 6 | N2 (азот), C2H2 (этилен) |
| Деликатная | Менее определено | Бензол, нафталин |
Молекулярные формулы органических соединений
Молекулярная формула позволяет узнать, какие элементы присутствуют в молекуле и в какой пропорции они соединены. Она состоит из символов химических элементов, обозначенных их химическими символами (например, С для углерода, Н для водорода, О для кислорода и т.д.), и индексов, указывающих количество атомов каждого элемента в молекуле.
Например, молекулярная формула для воды (H2O) показывает, что в молекуле есть два атома водорода (H) и один атом кислорода (O). Таким образом, мы можем определить состав и структуру молекулы воды.
Для более сложных молекул используются более сложные молекулярные формулы. Например, молекулярная формула для этилового спирта (C2H5OH) показывает, что в молекуле есть два атома углерода (C), шесть атомов водорода (H) и один атом кислорода (O). Такая формула позволяет более подробно описать структуру молекулы этилового спирта.
| Молекула | Молекулярная формула |
|---|---|
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
Вышеприведенная таблица показывает некоторые примеры молекулярных формул органических соединений. Она демонстрирует, как символы химических элементов и индексы используются для обозначения состава молекулы соединения.
Использование молекулярных формул позволяет химикам легко коммуницировать и описывать химические соединения, а также проводить различные расчеты и исследования. Поэтому знание молекулярных формул является важным фактором в органической химии.
Символическое обозначение элементов
Символы элементов могут быть составлены из одной или двух букв латинского алфавита. Некоторые символы совпадают с первыми буквами названия элемента, например, H — водород, C — углерод.
В случае, когда первые буквы названия двух или более элементов совпадают, используются дополнительные символы для уникального обозначения элемента. Например, оксиген обозначается символом O, а олово — Sn.
Некоторые элементы обозначаются по-другому, чтобы сохранить соответствие символу первой буквы названия. Например, железо обозначается символом Fe, поскольку символ F уже использован для фтора.
Символическое обозначение элементов позволяет удобно записывать и читать формулы соединений, а также осуществлять манипуляции с ними при проведении химических реакций.
Описание графического представления
На графическом представлении молекулы каждый атом изображается в виде символа химического элемента, например, «C» для углерода или «O» для кислорода. Атомы обычно располагаются в плоскости исходя из их пространственного расположения в молекуле.
Связи между атомами в молекуле изображаются линиями. Линия представляет собой графическое представление ковалентной связи между атомами. Количество линий указывает на количество электронных пар, образующих связь между атомами. Например, между двумя атомами углерода в молекуле этана присутствует одна ковалентная связь, поэтому на графическом представлении будет изображена одна линия.
Кроме атомов и связей, графическое представление может также включать другие химические символы и обозначения. Например, чтобы указать наличие функциональных групп или специфических химических свойств, могут использоваться различные символы и обозначения.
Графическое представление молекул и структурных формул органических соединений является не только удобным инструментом для визуального представления химических структур, но и основой для анализа и изучения их свойств и реакций.
Структурные формулы органических соединений
Структурная формула представляет собой графическое изображение молекулы, где атомы представлены символами, а связи — линиями между символами. Важно соблюдать правила построения структурных формул, чтобы они были корректными и понятными для других химиков.
Структурные формулы позволяют увидеть основные элементы молекулы, такие как атомы углерода, водорода, кислорода и азота, а также другие атомы, которые могут входить в состав органического соединения. Они также позволяют увидеть, какие атомы связаны между собой, и какие группы атомов находятся внутри молекулы.
Структурные формулы можно упростить до эмпирического состава, указывая только типы атомов, и их количество в молекуле. Однако более детальные структурные формулы позволяют увидеть более сложные структуры, такие как кольца, ветвления и двойные и тройные связи.
Одним из способов представления структурных формул является использование таблиц, где каждый столбец представляет атомы, а каждая строка представляет связи. Таблицы удобны для представления сложных структур и позволяют наглядно показать связи между атомами и группами атомов.
| Атомы | Связи |
|---|---|
| C | — |
| H | — |
| O | = |
| N | # |
В данной таблице представлен пример простой структурной формулы, где атомы углерода, водорода, кислорода и азота обозначены соответствующими символами, а связи между атомами обозначены специальными символами, такими как «-» для одиночной связи, «=» для двойной связи и «#» для тройной связи.
Структурные формулы органических соединений играют ключевую роль в органической химии, позволяя увидеть и понять структуру молекулы. Они являются основой для анализа и изучения органических соединений, и позволяют предсказывать и понимать их свойства и реактивность.
Уровень содержания информации
В органической химии для описания связей между атомами в молекулах используется понятие кратности связи. Кратность связи указывает на количество электронных пар, которыми соединены атомы в молекуле.
Кратность связи может быть одиночной, двойной или тройной. Одиночная кратность связи обозначается одной линией, двойная — двумя линиями, тройная — тремя линиями.
Одиночная кратность связи означает, что атомы в молекуле соединены одной электронной парой. На каждый атом приходится одна связь. Примером органического соединения с одиночной кратностью связи является метан (CH4), где каждый атом углерода соединен с четырьмя атомами водорода.
Двойная кратность связи означает, что атомы в молекуле соединены двумя электронными парами. На каждый атом приходится две связи. Примером органического соединения с двойной кратностью связи является этилен (C2H4), где два атома углерода соединены между собой двумя связями.
Тройная кратность связи означает, что атомы в молекуле соединены тремя электронными парами. На каждый атом приходится три связи. Примером органического соединения с тройной кратностью связи является ацетилен (C2H2), где два атома углерода соединены между собой тройной связью.
| Кратность связи | Обозначение | Примеры |
|---|---|---|
| Одиночная | − | метан, этилен |
| Двойная | ═ | этин |
| Тройная | ≡ | нефты, этилин |
Для удобства представления кратности связи в молекулах используются структурные формулы, в которых связи обозначаются линиями или символами. Такая нотация позволяет легко определить количество электронных пар в каждой связи и ориентироваться в строении молекулы.
Использование стрелочек и линий
При изображении молекулярных и структурных формул органических соединений важно использовать стрелочки и линии для наглядного представления кратности ковалентной связи. Стрелочки и линии позволяют лучше понять, какие атомы связаны друг с другом и каким образом.
Стрелочки обычно используются для обозначения направления электронного дефицита в молекуле. Стрелочка, направленная от атома с более высокой электроотрицательностью к атому с более низкой электроотрицательностью, указывает на то, что электроны делятся неравномерно и в большей степени прикованы к атому с более высокой электроотрицательностью.
Линии могут обозначать как одиночные, так и множественные связи между атомами. Одиночная связь обозначается простой линией, множественная связь – двойной или тройной.
Одиночная связь представляет собой ковалентную связь, в которой два атома делят пару электронов. Двойная связь состоит из двух пар электронов, тройная – трех пар. Поэтому двойная и тройная связи являются более крепкими, чем одиночная связь.
Стрелочки и линии могут размещаться между атомами, как прямо, так и косо. Важно помнить, что линии и стрелочки – это всего лишь схематическое представление молекулы, и их расположение не всегда отражает реальное пространственное строение молекулы.
Использование стрелочек и линий позволяет наглядно и точно передать информацию о кратности ковалентной связи в органических соединениях. Это важный инструмент в химии, который помогает понять структуру и свойства молекул.
Вопрос-ответ:
Что такое кратность ковалентной связи?
Кратность ковалентной связи — это число электронных пар, которые образуют связь между атомами в молекуле. Кратность может быть одинарной (одна электронная пара), двойной (две электронные пары) или тройной (три электронные пары).
Как определить кратность ковалентной связи по структурной формуле?
Чтобы определить кратность ковалентной связи по структурной формуле, нужно посчитать количество линий (электронных пар), которые соединяют атомы в молекуле. Одна линия — это одиночная связь, две линии — это двойная связь, три линии — это тройная связь.
Какие молекулярные формулы соответствуют одиночной, двойной и тройной кратности ковалентной связи?
Молекулярная формула для одиночной кратности ковалентной связи — это формула, в которой атомы соединены одной линией. Для двойной кратности — атомы соединены двумя линиями, а для тройной кратности — тремя линиями.
Каковы особенности ковалентной связи в органических соединениях?
Ковалентная связь в органических соединениях имеет некоторые особенности. В органических молекулах часто встречаются связи смешанной кратности, то есть связи, которые нельзя однозначно отнести к одиночным, двойным или тройным. Например, в молекуле бензола все связи являются смешанными, они имеют промежуточную кратность между одиночной и двойной.