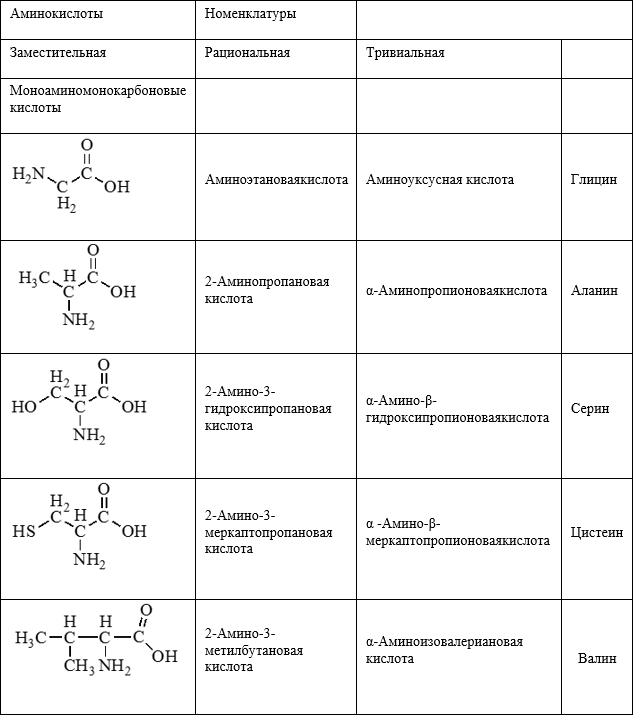
Амины — это органические соединения, которые содержат азот. Они включают в себя различные классы соединений, такие как аминокислоты, амиды, аминоксиды и пр. Амины являются важными молекулами в органической химии и играют важную роль в жизненных процессах. Одним из характерных свойств аминов является их базичность, или способность принимать протоны.
Базичность аминов обусловлена наличием свободных электронных пар на атоме азота. Атом азота образует три ковалентные связи с другими атомами, и оставшийся свободный электронный пар делает амины донорами электронов. Этот свободный электронный пар способствует образованию новой ковалентной связи с протоном, что приводит к образованию ионов аммония.
Одной из причин, почему амины считаются органическими основаниями, является их способность принимать протоны. Когда амин взаимодействует с кислотой, его электронный пар образует новую ковалентную связь с протоном из кислоты. Это взаимодействие приводит к образованию аммония, которая является конъюгированной кислотой амина.
Наличие аминогруппы
Аминогруппа (-NH2) играет ключевую роль в характеристике аминов как органических оснований. Аминогруппа состоит из атома азота, связанного с двумя атомами водорода и остатком органического соединения. Эта группа предоставляет аминам способность принимать протоны (H+) и образовывать ион аммония (NH4+).
Аминогруппа придаёт аминам основные свойства, так как она способна принимать протоны из раствора и формировать стостояние равновесия с различными формами заряженности.
Аминогруппа также является нуклеофильной, это значит, что она может быть исходным реагентом в нуклеофильных реакциях, например, в присоединении карбоцитов к электрофильным центрам.
За счет наличия аминогруппы, амины могут образовывать водородные связи с окислами и водородами, что делает их слабыми основаниями в органической химии. Водородные связи реализуют положительную поляризацию на атоме азота, что улучшает возможность принимать протоны.
| Амин | Структура | Название |
|---|---|---|
| Метиламин |  | CH3NH2 |
| Этиламин |  | C2H5NH2 |
| Пропиламин |  | C3H7NH2 |
Приведенные выше примеры показывают структуру и название некоторых простых аминов. Каждый из них содержит аминогруппу, состоящую из атомов азота и водорода, придающую им основные свойства.
Описание аминогруппы
Аминогруппа — это гидрофильная группа, что означает, что она обладает аффинитетом к воде. В связи с этим, аминогруппа может образовывать водородные связи с водой и другими молекулами, содержащими гидрофильные группы. Благодаря этому свойству, аминогруппа может образовывать стабильные водородные связи с кислородом или азотом в других молекулах.
Амины, содержащие аминогруппу, могут играть важную роль в биологических процессах организма. Они могут выполнять функции буфера, регулировать pH-уровень, участвовать в синтезе белков и многое другое. Кроме того, амины с аминогруппой проявляют базовые свойства, так как атом азота в их составе обладает дополнительным паром электронов, который может принимать протоны от других молекул.
В связи с этим, амины считаются органическими основаниями. Они могут реагировать с кислотами, образуя соли и воду. Примером этого является реакция аминов с карбоновыми кислотами, которая приводит к образованию аминосолей.
Итак, аминогруппа — это ключевой компонент аминов, обладающий гидрофильностью и базовыми свойствами. Она играет важную роль в органической химии и биологии, а амины с аминогруппой считаются органическими основаниями из-за своей способности реагировать с кислотами.
Реакции аминогруппы с кислотами
Одной из ключевых реакций аминогруппы является ее реакция с кислотами. При взаимодействии аминогруппы с кислотами, происходит образование солей, которые также называют аммонийными солями.
Реакция аминогруппы с кислотами происходит следующим образом: аминогруппа принимает на себя протон (Н+) от кислоты, образуя ион аммония (NH4+). В результате образуются соли аммония, которые растворяются в воде и образуют ионные растворы.
Данная реакция является обратимой и происходит в присутствии воды или другого растворителя. Она обеспечивает аминам способность нейтрализовать кислотные вещества и проявлять свойства оснований.
Кроме образования солей, реакция аминогруппы с кислотами также может сопровождаться образованием слабых оснований в виде аммиака (NH3) или его производных.
Таким образом, реакции аминогруппы с кислотами играют важную роль в химических свойствах аминов и подтверждают их статус органических оснований.
Образование аммония при деятельности аминогруппы
Аминогруппа, являющаяся основной функциональной группой аминов, обладает способностью образовывать аммонийные ионы (NH4+) при взаимодействии с кислородсодержащими соединениями.
Процесс образования аммония является результатом протонирования аминогруппы в амине. В качестве протонирующего агента может выступать вода или другие кислородсодержащие соединения с сильным положительным зарядом.
| Реакция образования аммония: | |
|---|---|
| R-NH2 + H3O+ | R-NH3+ + H2O |
В данной реакции амин выбирает протон от протонирующего агента, а оставшаяся часть молекулы становится аммонийным ионом.
Образование аммония является одним из признаков основности аминов. Амины реагируют с кислотами, принимая на себя протоны и образуя соли. Также аминогруппа может взаимодействовать с другими кислородсодержащими соединениями, образуя соединения с положительным зарядом. Этот процесс является основанием для классификации аминов как органических оснований.
Изменение pH раствора
Изменение pH раствора при добавлении аминов зависит от их концентрации, положительного заряда и степени ионизации. Высокая концентрация аминов приводит к более значительному изменению pH, а амин с более высокой степенью ионизации будет более эффективно принимать протоны и повышать pH раствора.
Благодаря способности аминов изменять pH раствора, они широко используются в химической промышленности и лабораториях для регулирования pH различных систем, таких как растворы для хранения и транспортировки лекарственных препаратов и пищевых добавок, а также в производстве удобрений, красителей и других продуктов, где необходим контроль pH.
Образование гидроксида аммония
Реакция образования гидроксида аммония может быть записана следующим образом:
- Аммиак (NH3) реагирует с молекулой воды (H2O), образуя гидроксид аммония (NH4OH).
- Реакция идет по следующему уравнению: NH3 + H2O → NH4OH.
- При этой реакции аммиак передает один протон (H+) молекуле воды, образуя ион гидроксида (OH—).
- Образовавшийся ион гидроксида связывается с ионом аммония (NH4+), образуя молекулу гидроксида аммония (NH4OH).
Гидроксид аммония обладает амфотерными свойствами, то есть он может действовать как кислота или как основание в зависимости от условий реакции. Именно благодаря своим щелочным свойствам гидроксид аммония считается органической основой.
Высокая щелочность аминов
Амины считаются органическими основаниями из-за их высокой щелочности.
Давайте разберемся, что такое щелочность и почему амины обладают высокой щелочностью.
Щелочность — это свойство вещества образовывать ион гидроксида (OH-), когда оно растворяется в воде. Щелочные растворы обладают высоким значением pH, равным более 7.
Амины обладают высокой щелочностью из-за наличия в своей структуре нескольких связанных с атомом азота водородных атомов. Атом азота в амине обладает свободной парой электронов, которая способна принимать протоны (H+) от воды.
Пример: реакция между амином метиламином (CH3NH2) и водой (H2O):
CH3NH2 + H2O → CH3NH3+ + OH-
В этой реакции пара электронов на азоте метиламина принимает протон от воды, образуя ион метиламмония (CH3NH3+). Оставшаяся часть молекулы воды образует ион гидроксида (OH-).
Таким образом, амины способны образовывать щелочные растворы и взаимодействовать с кислотами, вытесняя из них протоны.
Обратите внимание: Чем больше электродонорная способность амина, тем выше его щелочность. Это объясняется тем, что атом азота становится более доступным для протонов соответственно увеличению количества водородных атомов.
Влияние изменения pH на химические процессы
Изменение значения рН может значительно изменить скорость и направление химической реакции. Например, при повышении значения рН некоторые реакции могут замедляться или даже прекращаться, в то время как другие реакции могут ускоряться. Это связано с изменением концентрации ионов в растворе, что влияет на протекание реакций.
В контексте аминов, изменение значения рН может существенно повлиять на их кислотно-основные свойства. Амины считаются органическими основаниями, так как они способны принимать протоны от кислых реагентов. При повышении значения рН, амины могут становиться менее основными или даже не реагировать вовсе, так как количество доступных протонных акцепторов снижается.
Также стоит отметить, что изменение значения рН может влиять на растворимость различных соединений. Некоторые соединения могут стать менее растворимыми при изменении значения рН. Влияние рН на химические процессы важно учитывать при проведении экспериментов и в промышленности, где необходимо аккуратно контролировать условия реакции для достижения желаемого результата.
Способность аминов к образованию солей
Амин, будучи основанием, может принять протон от кислоты, образуя солю амина. При этом, амин становится положительно заряженным катионом, так как приобретает дополнительный протон. Примером такой реакции может быть образование хлорида триметиламмония ([(CH3)3NH]+Cl-), при взаимодействии триметиламина и соляной кислоты.
Способность аминов к образованию солей позволяет им выступать в роли оснований в различных химических реакциях. Именно за счет реакций с кислотами амины проявляют свои основные свойства, такие как амфотерность и нейтрализация кислот.
Вопрос-ответ:
Что такое амины?
Амины — это органические соединения, содержащие азотную группу (NH2) в своей структуре. Они могут быть как насыщенными, так и несатисфицированными, и обладают базичными свойствами.
Почему амины считаются органическими основаниями?
Амины считаются органическими основаниями из-за наличия азотной группы (NH2) в их структуре. Азотная группа обладает парно-непарной электронной парой, которая способна принимать протоны от других соединений, проявляя базичность.
Какие примеры аминов можно привести?
Примерами аминов являются аммиак (NH3), метиламин (CH3NH2), этиламин (C2H5NH2), анелидин (C6H5NH2) и другие соединения, содержащие азотную группу (NH2).
Каким образом амин могут принимать протоны?
Амин могут принимать протоны, так как азотная группа (NH2) обладает парно-непарной электронной парой, которая притягивает положительно заряженные ионы (протоны). Электронная пара азота образует координационную связь со входящим им протоном, что способствует образованию связи.
Какие другие соединения могут проявлять базичность?
Кроме аминов, базичность могут проявлять другие органические соединения, содержащие электронные пары, способные принимать протоны. Например, алкенилы, анилилы, анионы карбоната и гидроксида, энолаты и другие.
Почему амины считаются органическими основаниями?
Амины считаются органическими основаниями из-за присутствия в их структуре непарного электронного парамагнитного электрона, который может быть использован для образования новой химической связи с протоном. Другими словами, амины способны принимать протоны от других молекул или реагировать с кислотами, что характерно для оснований.
Какие причины позволяют считать амины органическими основаниями?
Существуют несколько причин, почему амины считаются органическими основаниями. Во-первых, они обладают электронными парами, которые могут принять протон, образуя новую химическую связь. Во-вторых, амины могут реагировать с различными кислотами, образуя соли. Кроме того, амины обладают низкой электроотрицательностью, что также способствует их способности взаимодействовать с протонами и реагировать с кислотами.