Окисление сопровождаемое выделением теплоты – это один из основных типов химических реакций, который происходит при взаимодействии веществ с кислородом. В результате такой реакции происходит передача электронов от одного вещества к другому, при этом происходит изменение окислительного состояния атомов.
В процессе окисления происходит энергетическое освобождение, в результате которого происходит выделение теплоты. Это связано с тем, что вокруг проводников тепла окружающие их вещества начинают двигаться быстрее, увеличивая свою температуру.
Основным принципом окисления с выделением теплоты является сохранение энергии. В результате реакции всех веществ в системе становится меньше, чем до реакции. При этом некоторая часть энергии превращается в теплоту, которая передается окружающим веществам.
Окисление с выделением теплоты широко применяется в различных областях науки и промышленности. Например, взаимодействие горючих веществ с кислородом при горении является процессом окисления, сопровождаемым выделением тепла. Это позволяет использовать эту энергию в виде тепла и света.
Окисление сопровождаемое выделением теплоты
Окисление сопровождается соединением вещества с кислородом, который является сильным окислителем. В результате этой реакции происходит выделение энергии в виде теплоты.
Выделение теплоты при окислении играет важную роль во многих процессах, как в природе, так и в промышленности. Например, сгорание древесины, угля или нефти – это окислительные реакции, сопровождающиеся выделением больших количеств теплоты.
Выделение теплоты при окислении также используется в сфере энергетики. В тепловых электростанциях происходит сжигание топлива (угля, нефти или газа), что приводит к выделению теплоты. Эта теплота используется для нагрева воды и превращения ее в пар, который затем приводит в движение турбин и генерирует электричество.
Окисление может протекать медленно или быстро в зависимости от различных факторов, таких как температура, концентрация реагентов и наличие катализаторов. Однако, в любом случае, окисление всегда сопровождается выделением теплоты.
Окисление как химическая реакция:
Окисление представляет собой химическую реакцию, при которой вещество теряет электроны и/или приобретает кислород. Такие реакции обычно сопровождаются выделением теплоты.
Окисление может происходить как в гетерогенных, так и в гомогенных системах. В гетерогенных системах реакция протекает между веществами, находящимися в разных фазах, например, между твердым веществом и газом или жидкостью. В гомогенных системах все вещества находятся в одной фазе, например, в растворе или газовой смеси.
Окисление является одним из основных принципов химии и встречается во многих химических реакциях, в том числе в обычной горении. В результате окисления вещества могут изменять свои физические и химические свойства.
| Вещество, окисляющееся (окислитель) | Вещество, восстанавливающееся (восстановитель) |
|---|---|
| Кислород | Водород |
| Оксиды неметаллов | Металлы |
| Кислоты | Основания |
Окисление играет важную роль в промышленности, в химическом анализе и в органической химии. Она помогает понять, как происходят различные химические реакции и как вещества трансформируются друг в друга.
Процесс окисления:
Окисление представляет собой химическую реакцию, сопровождающуюся выделением теплоты. В процессе окисления происходит передача электронов от одного вещества к другому. Окислитель, в данном случае, получает электроны и тем самым увеличивает свою степень окисления. Вещество, отдающее электроны, называется восстановителем.
Процесс окисления является одним из основных принципов химических реакций и имеет широкое применение в различных сферах. Например, окисление может использоваться для получения энергии, как в случае с сжиганием топлива. Окисление также играет важную роль в органической химии, где многочисленные биологические процессы зависят от передачи электронов.
Процесс окисления может протекать быстро или медленно в зависимости от условий реакции. Некоторые окисления происходят мгновенно, с высокой скоростью реакции, в то время как другие могут занимать длительное время.
Окислительно-восстановительные реакции:
Важным аспектом окислительно-восстановительных реакций является наличие веществ, называемых окислителями и восстановителями. Окислитель – это вещество, которое само вступает в реакцию окисления и получает электроны от вещества, вступающего в реакцию восстановления. Восстановитель – это вещество, которое само вступает в реакцию восстановления и отдает электроны окислителю.
Примеры окислительно-восстановительных реакций включают сгорание, ржавление металлов, процессы электролиза и многие другие. Важно отметить, что данные реакции происходят с выделением теплоты. Такое явление объясняется тем, что в реакции окисления происходит освобождение связанной энергии. Эта энергия, освобождающаяся в процессе окисления, является источником тепла.
Окислительно-восстановительные реакции являются основой многих процессов в природе и промышленности. Они используются в батареях, аккумуляторах, электролизере и многих других устройствах и процессах. Понимание этих реакций позволяет улучшить производительность и эффективность множества систем и процессов.
Окислитель и восстановитель:
Окислитель и восстановитель могут быть как элементами, так и соединениями. Реакция окисления-восстановления возникает, когда окислитель и восстановитель встречаются друг с другом и обмениваются электронами. Этот обмен электронами сопровождается выделением тепла.
Окислитель обладает способностью получать электроны, что приводит к его окислению. Он должен иметь высокую электроотрицательность, что значит, что он обладает большой способностью притягивать электроны. Примерами окислителей являются кислород, хлор и пероксиды.
Восстановитель, напротив, обладает способностью отдавать электроны, что приводит к его восстановлению. Он имеет низкую электроотрицательность, что значит, что он слабо притягивает электроны. Примерами восстановителей являются металлы, аммиак и сероводород.
Реакции окисления-восстановления играют важную роль во многих химических процессах, таких как горение, дыхание, окисление металлов и многие другие. Знание об окислителях и восстановителях помогает понять и объяснить эти процессы, а также применять их в различных областях, включая промышленность и медицину.
Выделение теплоты при окислении:
Выделение теплоты при окислении основано на том, что окислитель принимает электроны от вещества, окисляемого. В ходе этой реакции происходит положительное изменение энергии, что означает, что реакция является экзотермической и выделяет энергию в виде тепла.
Выделение теплоты при окислении играет важную роль в различных процессах и реакциях, таких как горение, дыхание и многие другие. Энергия, выделяемая в результате окисления, может использоваться в различных технических и промышленных процессах.
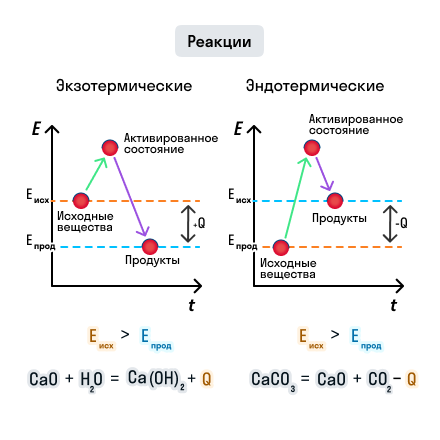
Энтальпия реакции:
Обычно, энтальпию реакции обозначают символом ΔH и измеряют в кДж/моль. Положительное значение ΔH указывает на выделение теплоты во время реакции (экзотермическая реакция), а отрицательное значение указывает на поглощение теплоты (эндотермическая реакция).
Значение энтальпии реакции зависит от количества веществ, участвующих в реакции, и от их состояния (газ, жидкость или твёрдое вещество). Оно определяется разностью энтальпий реагентов и продуктов реакции.
Знание энтальпии реакции позволяет оценить энергетическую эффективность химических процессов, и использовать это знание для решения практических задач в химии и технике.
Калориметрический метод:
Для проведения калориметрической реакции необходимо провести следующие шаги:
- Подготовить калориметр – чашу, в которую будет помещаться реакционная смесь.
- Измерить массу итоговой смеси реагентов, а также температуру в начальный момент времени.
- Составить реакционную смесь и внести ее в калориметр.
- Замерить изменение температуры в калориметре с течением времени.
- Рассчитать количество выделившегося тепла с помощью уравнения:
Q = mcΔT,
где Q – количество выделившегося тепла (в джоулях), m – масса смеси (в граммах), c – теплоемкость смеси (в джоулях на градус Цельсия), ΔT – изменение температуры.
Калориметрический метод позволяет измерить количество энергии, выделяющейся в результате окислительно-восстановительных реакций, а также определить теплоемкость различных веществ. Этот метод широко применяется в химической и физической науке для изучения энергетических процессов различных веществ и реакций.
Примеры реакций с тепловым эффектом:
Еще одним примером реакции с тепловым эффектом является реакция нейтрализации. Реакция нейтрализации происходит между кислотой и щелочью, при этом образуется соль и вода. Во время этой реакции выделяется тепло. Нейтрализационные реакции широко применяются в бытовой химии, в производстве лекарств, а также в других областях промышленности.
Также можно привести пример окислительно-восстановительной реакции. Во время такой реакции одно вещество окисляется, а другое вещество восстанавливается. При этом может происходить выделение тепла. Окислительно-восстановительные реакции широко применяются в производстве батареек, аккумуляторов и других источников энергии.
Приведенные примеры реакций с тепловым эффектом демонстрируют важность понимания химических процессов, включающих изменение энергии. При изучении и применении химии важно учесть тепловые эффекты, которые могут оказывать значительное влияние на окружающую среду и нашу повседневную жизнь.
Вопрос-ответ:
Какие вещества могут претерпевать окисление?
Окисление может претерпевать большинство органических и неорганических веществ.
Что такое окисление и как оно происходит?
Окисление — это процесс, при котором вещество теряет электроны. Оно происходит путем реакции вещества с кислородом или другим окислителем.
Почему окисление сопровождается выделением теплоты?
Окисление сопровождается выделением теплоты, потому что это реакция экзотермическая, то есть при окислении выделяется энергия в виде тепла.
Какие принципы лежат в основе окисления и восстановления?
В основе окисления и восстановления лежит принцип совместного изменения степени окисления атомов. Вещество, окисляющееся, теряет электроны и повышает свою степень окисления, а вещество, восстанавливающееся, получает электроны и понижает свою степень окисления.