Ферменты – это белковые молекулы, играющие ключевую роль во всех биохимических реакциях, происходящих в организме. Они ускоряют химические реакции, что позволяет клеткам производить необходимые для жизни молекулы и поддерживать все процессы в организме на должном уровне. Чтобы понять, как ферменты работают, необходимо разобраться в их структуре и функциональных свойствах.
Ферменты состоят из двух основных частей: апоэнзима и кофактора. Апоэнзим представляет собой белковую часть фермента, которая отвечает за его катализирующую активность. Кофактор, в свою очередь, является не белковым компонентом фермента, необходимым для его активности. Однако, наиболее важным и интригующим аспектом структуры фермента является активный сайт.
Активный сайт – это узкая пространственная область на апоэнзиме, где происходит основной каталитический процесс, т.е. превращение субстрата в конечный продукт. Активный сайт обладает специфичностью к отдельным молекулам, что связано с наличием определенных функциональных групп и резидуов. Образование комплекса активного сайта с субстратом ведет к образованию временно устойчивого промежуточного состояния, после которого происходит химическая реакция и образуется конечный продукт.
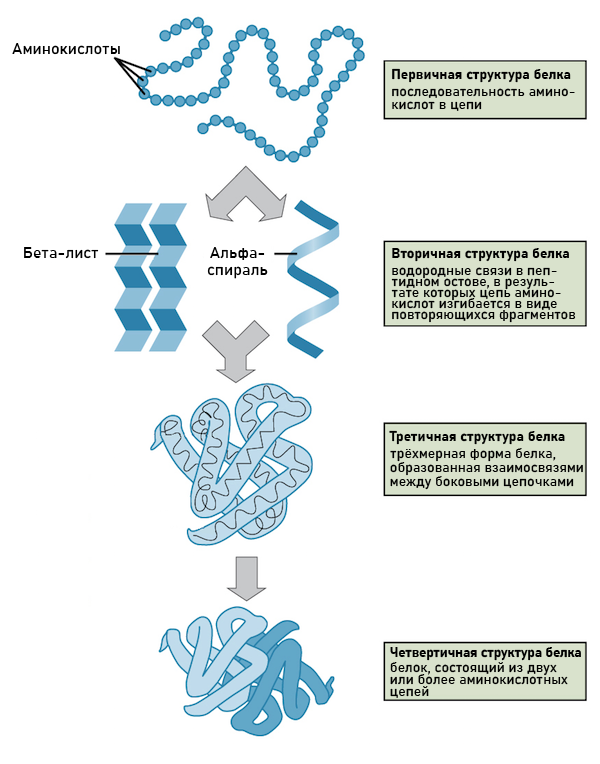
Ферментная молекула и ее структура
Структурная часть ферментной молекулы, где осуществляется каталитическая активность, называется активным центром. В активном центре находятся аминокислоты, которые взаимодействуют с субстратом и приводят к его превращению. Эти аминокислоты обладают определенной конфигурацией и химическими свойствами, что позволяет им выполнять свою функцию.
Ферментная молекула может иметь различные структуры, включая простую и сложную. Простые ферменты состоят только из белка, в то время как сложные ферменты содержат помимо белка еще и небелковые группы (как ковалентно связанные с ними кофакторы или необходимые для их активности ионные группы). Ковалентные кофакторы, такие как витамины или минералы, могут связываться с ферментной молекулой и помогать ей в каталитическом процессе.
Одна из особенностей ферментной молекулы – способность к специфичному связыванию с определенным субстратом. Каждый фермент способен взаимодействовать только с определенными молекулами. Это специфическое связывание обусловлено конкретным строением активного центра и электростатическими взаимодействиями между аминокислотами фермента и субстратом.
Аминокислотная последовательность
Аминокислотная последовательность играет важную роль в структуре и функции белка. Она определяет форму и свойства белка, а также его взаимодействие с другими молекулами. Изменение даже одной аминокислоты в последовательности может привести к изменению свойств и функции белка.
Исследование аминокислотной последовательности позволяет узнать многое о биологической функции белка. Сравнение последовательностей позволяет определить степень родства между разными видами белков и понять, как эволюционные изменения в последовательности могут влиять на их функцию.
Для анализа аминокислотных последовательностей используются различные методы, такие как секвенирование ДНК и протеомика. Современные технологии позволяют быстро и точно определить последовательность аминокислот и использовать эту информацию для понимания молекулярных процессов в клетке и развития болезней.
Таким образом, аминокислотная последовательность является важным компонентом ферментных молекул, где происходит основной каталитический процесс. Она определяет структуру и функцию белка, а также позволяет узнать больше о биологических процессах и эволюции.
Активный сайт фермента
Активный сайт обычно содержит определенные аминокислотные остатки, которые обладают ключевыми функциональными группами и могут участвовать в образовании и разрыве химических связей с субстратом. Эти функциональные группы могут быть активными центрами, такими как ацилы, катализирующие химические реакции на молекуле субстрата.
Основные характеристики активного сайта
Активный сайт фермента обладает рядом характеристик, которые определяют его специфичность и эффективность:
- Субстратоспецифичность: активный сайт может быть специфичным к определенному типу субстрата, располагая аминокислотными остатками, которые взаимодействуют только с определенными молекулярными группами субстрата.
- Индуцированная подгонка: активный сайт может менять свою форму и размеры, чтобы лучше приспособиться к субстрату и увеличить вероятность успешного катализа реакции.
- Кофакторы и коферменты: активный сайт может включать в себя дополнительные молекулы, которые участвуют в катализе реакции, например, металлические ионные кофакторы или коферменты.
Активный сайт фермента играет важную роль в биохимических процессах, обеспечивая эффективную и специфическую катализацию химических реакций. Изучение активных сайтов ферментов помогает понять механизмы реакций в клетке и разработать новые методы лечения различных заболеваний.
Каталитическая часть ферментной молекулы
Каталитическая часть ферментной молекулы представляет собой специализированную область, где происходит основной каталитический процесс. Эта часть фермента обеспечивает связывание субстрата, проведение химической реакции и высвобождение готового продукта.
Структура каталитической части ферментной молекулы
Каталитическая часть фермента обычно состоит из активного сайта, который содержит специфические аминокислотные остатки. Эти остатки обладают возможностью взаимодействия с молекулой субстрата. Активный сайт имеет своеобразную форму, а его аминокислоты организованы таким образом, чтобы обеспечить оптимальные условия для правильной ориентации субстрата и проведения реакции.
Кроме активного сайта, в каталитической части ферментной молекулы могут присутствовать дополнительные сайты, которые помогают взаимодействовать с кофакторами или другими молекулами, участвующими в каталитическом процессе.
Функциональная изменчивость
Функциональная изменчивость ферментов обусловлена структурной гибкостью определенного участка молекулы, называемого активным центром. Активный центр представляет собой специфичную поглубленную ямку или туннель, в котором происходит каталитическая реакция.
Ключевую роль в функциональной изменчивости ферментов играют аминокислотные остатки, составляющие активный центр. Именно они определяют степень специфичности фермента к определенному веществу и обеспечивают каталитическую активность фермента.
Структурные особенности активного центра
Активный центр обладает следующими структурными особенностями:
- Способность образовывать водородные связи с субстратом;
- Присутствие амино-кислотных остатков с боковыми цепочками различной природы;
- Наличие ионов металлов для координации с субстратом;
- Формирование гидрофобных и гидрофильных областей для взаимодействия с различными молекулами.
Роль функциональной изменчивости
Функциональная изменчивость позволяет ферментам приспосабливаться к различным условиям и требованиям клетки. При изменении структуры активного центра фермент может катализировать новые реакции или изменить свою специфичность.
Функциональная изменчивость также позволяет ферментам участвовать в различных метаболических путях, обеспечивая баланс и эффективность клеточных процессов. Благодаря этому свойству ферменты способны регулировать скорость биохимических реакций и поддерживать гомеостаз в клетке.
Таким образом, функциональная изменчивость является важным аспектом работы ферментов и позволяет им выполнять множество функций в организме.
| Примеры ферментов | Катализируемые реакции |
|---|---|
| Липаза | Гидролиз жиров |
| Амилаза | Разрушение полисахаридов |
| Протеаза | Разложение белков |
Роль заместителей в каталитической деятельности
Кофакторы
Кофакторы представляют собой не белковые компоненты, способные активировать ферменты и участвовать в каталитической реакции. Они могут быть различной природы — органической или неорганической, и выполнять разнообразные функции. Кофакторы обеспечивают структурную стабильность ферментов и являются неотъемлемой частью активного центра, где происходит основной каталитический процесс.
Коэнзимы
Одним из видов кофакторов являются коэнзимы — органические молекулы, которые связываются с ферментом и способствуют его активации. Коэнзимы участвуют в переносе химических групп между молекулами и в энергетических реакциях. Они могут быть включены в активный центр фермента или связываться с ним временно. Коэнзимы обладают специфичностью, что позволяет им работать только с определенными ферментами.
Ковалентные группы
Некоторые заместители могут быть присоединены к ферменту посредством образования ковалентных связей. Эти группы могут включать адениновый нуклеотид, сиаловую кислоту и многие другие. Наличие таких дополнительных групп позволяет ферменту выполнять свои функции более эффективно и специфично.
Итак, заместители играют незаменимую роль в каталитической деятельности ферментов. Без них ферменты не смогут выполнять свои функции, и химические реакции в организме будут протекать слишком медленно или неэффективно.
Реакция и связывание субстратов
Реакция и связывание субстратов происходит в активном сайте фермента. Активный сайт представляет собой уникальную трехмерную структуру внутри фермента, которая обеспечивает оптимальные условия для протекания реакции. Именно здесь происходит связывание субстрата, т.е. начального вещества, с ферментом.
Связывание субстрата с активным сайтом фермента происходит благодаря взаимодействию различных химических групп, таких как аминокислотные остатки, ионные группы или кофакторы. Ключевой момент в специфичности фермента заключается в том, что активный сайт оптимально подходит только для определенного субстрата или группы субстратов. Это позволяет ферменту быть очень эффективным и специфичным к определенным химическим реакциям.
После связывания субстрата с активным сайтом происходит каталитическая реакция. Фермент изменяет структуру субстрата, образуя промежуточные комплексы, и затем освобождает конечный продукт реакции. Важно отметить, что ферменты сами не участвуют в реакции и не изменяются в ходе процесса, они лишь облегчают процесс превращения субстрата.
Реакция и связывание субстратов в ферментах являются сложными процессами, которые требуют точного совпадения между активным сайтом фермента и субстратом. Это обеспечивает эффективную и специфическую работу фермента, играющего важную роль в различных биохимических процессах.
Механизм каталитической реакции
Активный центр – это уникальная трехмерная структура внутри ферментной молекулы, обладающая определенными свойствами и функциями. Здесь происходит взаимодействие фермента с субстратом (исходным соединением) и образование комплекса, что позволяет значительно ускорить ход химической реакции.
Активный центр содержит активные места, которые могут образовывать связи с субстратом. За счет этого происходят ферментативные реакции: разрушение связей в субстрате и формирование новых связей для образования конечного продукта.
Специфическое строение активного центра и определенная последовательность аминокислотных остатков позволяют ферментам катализировать определенные типы реакций. Таким образом, каждый фермент обладает своим собственным уникальным механизмом каталитической реакции.
Механизм каталитической реакции обычно включает несколько стадий: инициация, образование комплекса фермент-субстрат, катализ химической реакции и разделение комплекса для образования конечного продукта и регенерации фермента.
Таким образом, понимание механизма каталитической реакции важно для изучения и понимания биологических процессов, участия ферментов в метаболизме, разработки новых лекарственных препаратов и других областей химии и биологии.
Регуляция ферментной активности
Ферменты играют важную роль во многих биологических процессах, катализируя различные химические реакции. Однако, чтобы обеспечить эффективную работу организма, активность ферментов должна быть тщательно регулируема.
Существует несколько способов регуляции ферментной активности:
- Ингибирование: некоторые молекулы, называемые ингибиторами, могут связываться с ферментами и блокировать их активность. Это позволяет организму временно останавливать или замедлять определенные реакции, когда они не нужны.
- Активация: другие молекулы, называемые активаторами, могут связываться с ферментами и повышать их активность. Это позволяет организму ускорять определенные реакции, когда они необходимы.
- Модуляция уровня экспрессии генов: активность ферментов может быть регулирована на уровне генной экспрессии. Организм может увеличивать или уменьшать количество определенных ферментов, в зависимости от текущих потребностей.
- Модификация ферментов: некоторые ферменты могут быть активированы или инактивированы путем химической модификации. Например, фосфорилирование или метилирование может изменить активность фермента.
Регуляция ферментной активности является важным механизмом поддержания гомеостаза в организме. Она позволяет точно контролировать химические реакции, поступающие в клетках, и адаптироваться к изменяющимся условиям окружающей среды.
Вопрос-ответ:
Что такое ферментная молекула?
Ферментная молекула — это белковая молекула, которая служит как катализатор в химических реакциях в живых организмах.
Какие функции выполняет ферментная молекула?
Ферментные молекулы выполняют ряд важных функций, таких как ускорение химических реакций, регуляция метаболических путей, участие в синтезе молекул и разрушение токсинов.
Что такое структурная часть ферментной молекулы?
Структурная часть ферментной молекулы — это определенная последовательность аминокислот, которая образует трехмерную структуру фермента и определяет его функциональные свойства и активность.
Где происходит основной каталитический процесс в ферментной молекуле?
Основной каталитический процесс в ферментной молекуле происходит в активном центре. Это узкое регион структуры фермента, который специфически взаимодействует с субстратом и ускоряет химическую реакцию.
Как называется часть ферментной молекулы, где происходит взаимодействие с субстратом?
Часть ферментной молекулы, где происходит взаимодействие с субстратом, называется активный сайт. Здесь происходит основной каталитический процесс и химическая реакция между ферментом и субстратом.