Третичная структура белка — это высшая структурная организация полипептидной цепи. Она представляет собой сложное пространственное складывание аминокислотного остова, которое обеспечивает его специфическую форму и функцию.
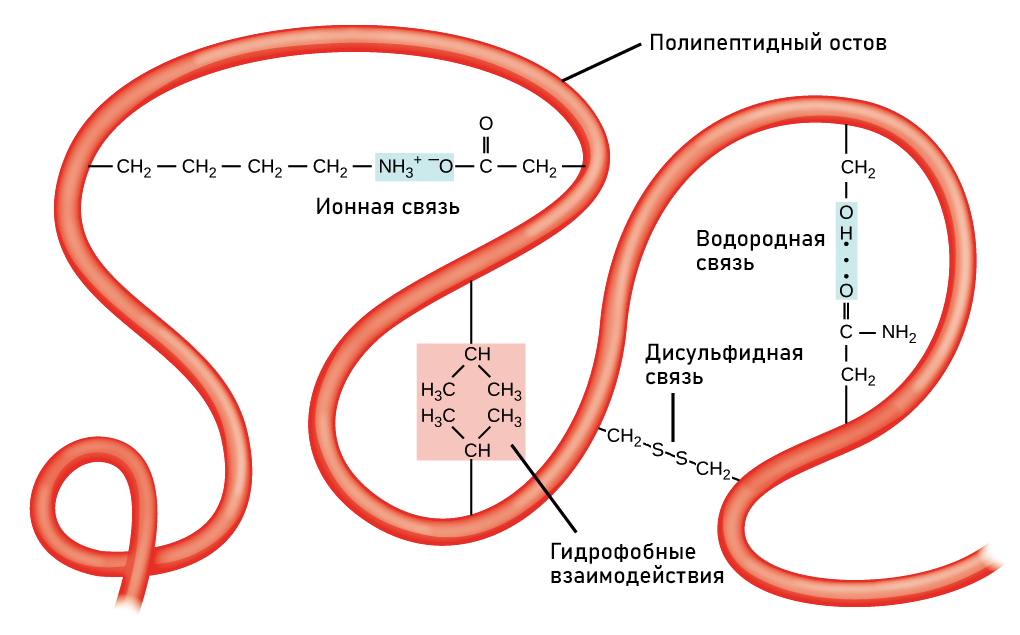
В третичной структуре белка взаимодействуют различные участки полипептидной цепи — альфа-спирали, бета-складки, огибающие и прочие элементы. Эти элементы связываются друг с другом с помощью сложных сил — гидрофобных и гидрофильных взаимодействий, солевых мостиков и дисульфидных связей.
Третичная структура белка определяет его свойства и функцию. Она позволяет белку выполнять свою роль в организме — катализировать реакции, транспортировать вещества, передавать сигналы и выполнять множество других биологических функций. Без третичной структуры белок не сможет выполнять свою функцию, так как его активный центр и специфичность будут потеряны.
Третичная структура белка может быть представлена в различных формах. Например, альбумин — один из самых изученных белков — имеет кольцевую третичную структуру. У других белков третичная структура может быть линейной, в виде сложно переплетенных спиралей и других сочетаний элементов. Названия третичных структур белков могут быть различными, их выбор обусловлен особенностями структуры и функцией конкретного белка.
Третичная структура белка и её определение
Одной из основных составляющих третичной структуры белка являются сложные связи между аминокислотными остатками, такие как водородные связи, сольватационные взаимодействия, ионно-дипольные связи, водно-водные взаимодействия и гидрофобные взаимодействия. Эти связи обеспечивают формирование пространственной структуры белка, такой как спиральная α-или β-структура.
Определение третичной структуры белка может быть получено с использованием различных экспериментальных методов, таких как рентгеноструктурный анализ, ядерный магнитный резонанс и моделирование на компьютере. Информация о третичной структуре белков имеет большое значение для понимания их функции и разработки лекарственных препаратов.
Третичная структура белка играет важную роль в его взаимодействии с другими молекулами, такими как ферменты, лиганды и белковые комплексы. Она определяет форму белка и его функциональные свойства, такие как способность связывать определенные субстраты, катализировать химические реакции и передавать сигналы.
Знание третичной структуры белка позволяет ученым понимать его механизм действия и влияние на биологические процессы. Это является фундаментальным для молекулярной биологии и биохимии и помогает в разработке новых методов диагностики и лечения различных заболеваний.
Что такое третичная структура белка?
На третичном уровне структуры белка происходит сложная пространственная взаимосвязь между атомами, обусловленная взаимодействием боковых цепей аминокислот. Это включает в себя формирование пространственных элементов структуры — спиральных α-геликсов и протяженных β-листов, а также их свертывание и связывание друг с другом в сложные трехмерные образования.
Третичная структура белка является важным аспектом его функциональности. Именно благодаря третичной структуре белки обладают своими особыми свойствами и способностью выполнять конкретные функции в организме. Например, активные центры ферментов обычно расположены в глубине третичной структуры и обладают точной энзиматической активностью благодаря особым конформационным особенностям.
Определение третичной структуры белка
Третичная структура белка представляет собой конкретное трехмерное расположение аминокислот в молекуле белка. Она определяется взаимодействием различных участков белковой цепи, таких как α-спирали, β-листы и случайные катушки. Эти взаимодействия образуют сложную трехмерную архитектуру белка, которая определяет его функцию и свойства.
Определение третичной структуры белка является важной задачей в биоинформатике и структурной биологии. Для этого используются различные методы, включая рентгеноструктурный анализ, ядерный магнитный резонанс и моделирование молекулярной динамики. Полученная трехмерная структура белка позволяет лучше понять его функциональные свойства и взаимодействия с другими молекулами.
| Метод | Преимущества | Недостатки |
|---|---|---|
| Рентгеноструктурный анализ | Высокое разрешение, точность и надежность | Требуется кристаллизация белка |
| Ядерный магнитный резонанс | Исследование в растворе, возможность изучения динамики | Низкая разрешающая способность для больших белков |
| Моделирование молекулярной динамики | Исследование динамики белка на микроскопическом уровне | Требует предварительной знания структуры |
Получение третичной структуры белка является важным шагом в изучении его функции и взаимодействий. С помощью полученных данных можно предсказывать взаимодействие белка с другими молекулами, разрабатывать лекарственные препараты и проводить рациональный дизайн белков.
Как определить третичную структуру белка?
- Рентгеноструктурный анализ — один из основных методов, который позволяет определить точную трехмерную структуру белка. Для этого проводят рентгеноструктурный анализ, в ходе которого с помощью рентгеновского излучения изучают дифракцию рентгеновских лучей на кристалле белка.
- Ядерно-магнитный резонанс (ЯМР) — метод, позволяющий изучать трехмерную структуру белка в растворе. С помощью ЯМР исследуют спиновые состояния ядер, что позволяет получить информацию о пространственной ориентации атомов в белке.
- Моделирование методом конструкторского подхода — это метод, в ходе которого строят модель третичной структуры белка на основе данных о его аминокислотной последовательности и ранее известных структур белков.
Каждый из этих методов имеет свои преимущества и ограничения, и часто для достоверного определения третичной структуры белка используется комбинация разных методов.
Методы определения третичной структуры
1. Кристаллография рентгеновского излучения. Этот метод основан на анализе дифракции рентгеновского излучения на кристаллической решётке белка. Измеряются углы и интенсивности отражённых лучей, и на основе этих данных вычисляется трехмерное распределение электронной плотности белка.
2. Ядерное магнитное резонансное спектроскопия (ЯМР). Этот метод позволяет изучать взаимодействие ядер с магнитным полем. Путем анализа ЯМР спектров можно определить расстояния между атомами и углы поворота связей в молекуле белка.
3. Электронная микроскопия (ЭМ). Этот метод использует электронное излучение для изображения молекулярных структур. С помощью ЭМ можно получить изображения трехмерных моделей молекул белка с высоким разрешением.
4. Биоинформатика. Этот метод основан на компьютерном анализе последовательности аминокислот в белке и поиском гомологичных белков для построения моделей третичной структуры.
5. Гомологическое моделирование. Этот метод основан на использовании уже известных структур белков для предсказания третичной структуры нового белка на основе гомологии и сходства последовательностей аминокислот.
6. Флуоресцентное исследование. Этот метод основан на использовании свойств флуоресцентных маркеров, которые могут связываться с определенными участками белка и предоставлять информацию о его структуре и конформационных изменениях.
Каждый из этих методов имеет свои преимущества и ограничения. В некоторых случаях необходимо применять комбинацию различных методов для получения максимально полной информации о третичной структуре белка.
Биологическое значение третичной структуры белка
Третичная структура белка представляет собой пространственное расположение аминокислотных остатков в полипептидной цепи. Она определяется взаимодействием боковых цепей аминокислот и междуцепочечными связями.
Биологическое значение третичной структуры белка заключается в его функциональности. Именно третичная структура определяет специфическую форму белка, которая является необходимой для его взаимодействия с другими молекулами в клетке.
Форма и расположение аминокислотных остатков в третичной структуре создают уникальные связи и взаимодействия, которые позволяют белку выполнять свою функцию. Например, третичная структура фермента определяет активный сайт, где происходят химические реакции субстрата.
Белки с разной третичной структурой выполняют разные функции в организме. Например, миоглобин, имеющий сферическую третичную структуру, связывает и переносит кислород в мышцах, а кератин, имеющий спиральную третичную структуру, формирует структуру волос и ногтей.
Понимание третичной структуры белка имеет большое значение в биологических и медицинских исследованиях. Изучение третичной структуры позволяет понять, как определенные мутации или изменения в генетической информации могут влиять на функцию белка и приводить к различным заболеваниям. Это открывает новые возможности для разработки лекарственных препаратов, которые могут модулировать функцию белков, и предоставляет информацию о механизмах действия различных ферментов и белковых комплексов.
Как называется третичная структура белка?
Каждый белок имеет свою уникальную третичную структуру, которая обусловлена его аминокислотной последовательностью и физико-химическими свойствами. Третичная структура определяет функцию белка и его специфичность взаимодействия с другими молекулами.
Научное обозначение третичной структуры белка
Научное обозначение третичной структуры белка обычно обозначается с помощью буквы «T» перед именем белка или использованием термина «третичная структура». Например, третичная структура митохондриального глутаматдегидрогеназного комплекса обозначается как «T-митохондриальный глутаматдегидрогеназный комплекс».
Третичная структура белка играет важную роль в его функциональной активности, поскольку определенные участки структуры могут быть ответственны за связывание с другими молекулами или катализ реакций. Изучение третичной структуры белка позволяет понять его функцию и может быть использовано для разработки лекарственных препаратов и терапевтических вмешательств.
Третичная структура белка может быть определена с помощью методов, таких как рентгеноструктурный анализ и ядерно-магнитное резонансное исследование. Эти методы позволяют увидеть расположение атомов в белке и воссоздать его трехмерную структуру.
Вопрос-ответ:
Что такое третичная структура белка?
Третичная структура белка – это трехмерное пространственное расположение аминокислотных остатков внутри молекулы белка. Она определяется взаимодействием боковых цепей аминокислот, образуя сложные пространственные связи.
Какие силы формируют третичную структуру белка?
Формирование третичной структуры белка происходит за счет различных сил, таких как водородные связи, ионные связи, гидрофобные взаимодействия и ван-дер-Ваальсовы силы. Они обеспечивают устойчивость третичной структуры и определяют ее конформацию.
Какая роль третичной структуры белка в его функциональности?
Третичная структура белка играет важную роль в его функциональности. Она определяет активные сайты и специфичность связывания с другими молекулами. Изменения в третичной структуре могут привести к потере функциональности белка.
Какая молекула отвечает за формирование третичной структуры белка?
Формирование третичной структуры белка осуществляется на уровне аминокислотной последовательности. Взаимодействие между аминокислотными остатками обеспечивает сворачивание молекулы в определенную трехмерную конформацию.
Как называется процесс формирования третичной структуры белка?
Процесс формирования третичной структуры белка называется складыванием (фолдингом). В ходе складывания белка молекула принимает определенную трехмерную конформацию, которая определяет ее функциональность.