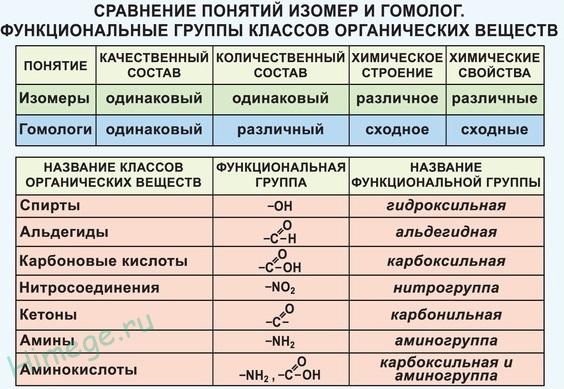
Изомеры в химии – это вещества, которые имеют одинаковый химический состав, но различаются по устройству и последовательности атомов. Такие вещества обладают одинаковым молекулярным составом, но различаются по своим физико-химическим свойствам.
Изомеры могут образовываться из молекул, состоящих из одного типа атомов, но различающихся по способам соединения этих атомов. Также могут существовать изомеры, полученные от разных классов химических соединений, но имеющие общие элементы в своем составе.
Изомерия в химии встречается повсеместно. Примерами являются алканы, циклоалканы, алкены и алкины, спирты, алдегиды, кетоны, эфиры, карбоновые кислоты, амины и другие классы химических соединений. Обычно, элементными составами данных изомеров являются углерод, водород, кислород, азот, сера, фосфор и многие другие химические элементы.
Что такое изомеры
У изомеров атомы элементов могут быть различно расположены, что приводит к разным свойствам вещества. Они могут образовываться при эндотермических реакциях или вводе энергии в систему.
Изомеры классифицируются по своей структуре и можем быть разделены на следующие категории:
| Вид изомера | Описание |
|---|---|
| Структурные изомеры | Вещества, имеющие одинаковый химический состав, но различающиеся в расположении атомов. |
| Функциональные изомеры | Вещества, имеющие одинаковый химический состав, но различающиеся по функциональным группам. |
| Геометрические изомеры | Вещества, различающиеся в пространственной конфигурации своих молекул. |
Примеры изомеров включают молекулы пропана и изобутана, которые имеют одинаковый химический состав (C3H8), но отличаются в структуре; а также этилен и ацетилен, которые имеют одинаковое химическое состав (C2H2), но различаются в своей геометрии.
Изомерия играет важную роль в химии, так как изомеры могут иметь разные физические и химические свойства, такие как плотность, точка кипения, растворимость и реакционная активность. Понимание изомерии помогает ученым предсказывать и объяснять эти свойства вещества.
Определение и основные принципы
Изомерия возникает из-за способности атомов углерода образовывать связи с другими атомами углерода и атомами других элементов в различном порядке и последовательности. Малейшие изменения в строении молекулы могут приводить к сильным различиям в свойствах и химической активности.
Главные принципы изомерии:
- Структурная изомерия: изомеры имеют различное расположение атомов в молекуле. Это может быть изомерия катамерии, цепная изомерия, позиционная изомерия, функциональная изомерия.
- Аллильная изомерия: проявляется в изомерии двойной связи, где атомы водорода и группы все-таки размещены в разн
Примеры и общие характеристики
1. Изомерия строения:
Изомеры строения имеют одинаковую молекулярную формулу, но атомы в молекуле соединяются по-разному. Примером может служить изомерия позиции, где функциональные группы располагаются в различных местах внутри молекулы.
2. Изомерия цепи:
Изомеры цепи обладают одной и той же молекулярной формулой и расположением функциональных групп, но отличаются длиной углеродной цепи. Например, пентан и гексан являются изомерами цепи.
3. Изомерия функциональных групп:
Изомеры функциональных групп имеют одинаковую молекулярную формулу и наличие одинакового числа углеродных и других атомов, но различаются по типу функциональной группы. Например, этиловый спирт (C₂H₅OH) и метоксиметан (CH₃OCH₃) являются изомерами функциональных групп.
4. Изомерия геометрическая:
Геометрическая изомерия возникает, когда атомы в молекуле связаны двойными или тройными связями, и их расположение отличается. Примерами могут служить изомеры З- и Е-бутена, которые имеют разной конфигурации двойной связи.
Изучение и понимание изомерии в химии позволяет более глубоко понять химические связи и свойства вещества.
Физические и химические свойства
Физические свойства изомеров, такие как температура плавления и кипения, плотность, вязкость и т. д., могут значительно различаться. Например, изомеры алканов имеют разные температуры кипения, в зависимости от их структуры. Строение молекулы изомеров влияет на взаимодействие между молекулами, что может приводить к отличиям в физических свойствах.
Химические свойства изомеров также различаются. Изомеры могут иметь разную реакционную способность и скорость реакций. Например, изомеры алканов могут подвергаться различным реакциям горения или добавления хлора. Структура молекулы изомера определяет его реакционную способность и взаимодействие с другими веществами.
Таким образом, физические и химические свойства изомеров являются следствием их структуры и внутреннего строения молекулы. Понимание этих свойств позволяет лучше изучить химическое поведение веществ и использовать их в различных областях науки и промышленности.
Виды изомеров
В химии существует несколько типов изомеров, которые могут образовываться из одного и того же молекулярного состава, но имеют различную структуру и свойства. Ниже представлены основные виды изомеров:
- Структурные изомеры: эти изомеры различаются взаимным расположением атомов в молекуле. Например, цепные изомеры обладают различными угловыми и линейными структурами, а функциональные изомеры различаются функциональными группами, такими как алкены, алканы и альдегиды.
- Конформационные изомеры: эти изомеры обладают разными пространственными конформациями, но молекулярные связи не нарушаются. Например, циклооктан может существовать в форме ‘обручей’, где атомы углерода расположены в прямой линии, или в форме ‘стула’, где атомы углерода образуют кольца.
- Оптические изомеры: эти изомеры могут различаться в своей оптической активности, то есть способности вращать плоскость поляризованного света. Оптические изомеры делятся на два типа: D-изомеры (дэкстро) и L-изомеры (лево).
- Строительные изомеры: это изомеры, которые отличаются взаимным порядком связей между атомами, но имеют одну и ту же эмпирическую формулу. Это может включать различные изомеры цепей, групп и кольца.
Изучение различных видов изомеров в химии помогает лучше понять структуру и свойства соединений. Это имеет большое практическое значение в различных областях, включая фармацевтику, пищевую промышленность и синтез органических соединений.
Структурные изомеры
Структурные изомеры могут отличаться в основной цепи углеродных атомов, наличии или отсутствии функциональных групп, наличии двойных или тройных связей между атомами, а также в разной конфигурации атомов.
Существует несколько типов структурной изомерии, включающих:
- Цепные изомеры: в молекулах данных изомеров атомы присоединены друг к другу различным способом, что приводит к образованию разных структур.
- Функциональные изомеры: эти изомеры имеют одну и ту же цепь углеродных атомов, но различные функциональные группы.
- Позиционные изомеры: эти изомеры отличаются в расположении функциональных групп на основной цепи углеродных атомов.
- Геометрические изомеры: такие изомеры различаются в расположении атомов в пространстве и могут принимать разные конфигурации (цис- и транс-изомеры).
Структурная изомерия играет важную роль в химии, так как позволяет получить вещества с разными свойствами на основе одного и того же химического состава. Это позволяет ученым и инженерам создавать новые материалы, применять их в различных отраслях науки и техники.
Изомеры валентности
Изомеры валентности возникают в результате различного распределения электронов между атомами молекулы, что приводит к разным компоновкам атомов в пространстве и различному строению молекулы.
Примерами изомеров валентности являются азот и оксиген, которые могут образовывать различные соединения с одинаковой суммарной формулой NO2. В зависимости от валентности азота и оксигена, образуются два изомера валентности: одно изомерное соединение имеет двойную связь между атомами азота и оксигена (NO2), а другое имеет одинарную и тройную связь между атомами азота и оксигена (ONO).
Изомеры валентности имеют различные физические и химические свойства, такие как точка кипения, плотность и активность в реакциях.
Вопрос-ответ:
Что такое изомеры в химии?
Изомеры — это вещества, имеющие одинаковый молекулярный состав, но различающиеся по строению и свойствам.
Каковы примеры изомерии?
Примеры изомерии включают геометрическую изомерию, оптическую активность и структурную изомерию.
Что такое геометрическая изомерия?
Геометрическая изомерия возникает, когда молекулы имеют одинаковый молекулярный состав, но отличаются в пространственном расположении атомов или групп атомов. Примерами геометрической изомерии являются цис- и транс-изомеры в органических соединениях.
Каковы примеры структурной изомерии?
Примерами структурной изомерии являются цепные изомеры, функциональные группы и группы двойной связи. Например, молекулы бутана и изобутана являются цепными изомерами, так как их атомы углерода различаются по структуре.
Видео:
7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химии