Катализаторы – это вещества, которые ускоряют химические реакции, не участвуя в них сами. Они снижают энергию активации реакции, облегчая протекание химических превращений. Благодаря катализаторам можно значительно сократить время реакции, что особенно важно в промышленности, где скорость процессов является критическим параметром.
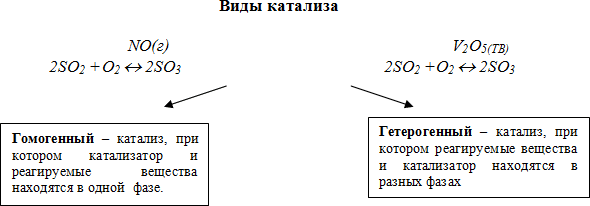
Катализаторы могут быть различными по природе и структуре. Существуют гетерогенные и гомогенные катализаторы. Гетерогенные катализаторы представляют собой твёрдые или жидкие вещества, отличные от реагентов. Они обычно находятся в контакте с реагентами в реакционных системах. Гомогенные катализаторы, напротив, существуют в одной фазе вместе с реагентами.
Применение катализаторов широко распространено в различных отраслях промышленности. Одним из наиболее известных примеров является катализатор, используемый в процессе гидрирования нефти. В этом процессе катализатор ускоряет взаимодействие молекул водорода с молекулами нефти, что позволяет получить продукты с высоким содержанием полезных компонентов.
Катализаторы также активно применяются в производстве пластмасс, удобрений, синтезе органических соединений и во многих других отраслях химической промышленности. Они помогают повысить эффективность процессов, снизить затраты на сырье и энергию, а также сделать их более экологически чистыми.
Что такое катализаторы?
Катализаторы являются ключевыми компонентами промышленных процессов, таких как производство пластиков, удобрений, нефти и многих других продуктов. Они позволяют значительно улучшить эффективность и экономичность этих процессов, а также сократить выбросы вредных веществ.
Катализаторы могут быть разных типов, в зависимости от процессов, которые они активируют. Некоторые катализаторы работают для общих реакций, например, окисления или восстановления, тогда как другие специализируются на конкретных химических превращениях.
Примеры катализаторов включают металлы, такие как платина, никель или палладий, а также неорганические вещества, такие как оксид алюминия или кремний. Органические молекулы также могут выступать в роли катализаторов, например, ферменты.
Применение катализаторов в химической промышленности позволяет существенно сократить энергозатраты в процессах производства, снизить степень загрязнения окружающей среды и использовать сырье более эффективно. Катализаторы также играют важную роль в различных сферах науки и технологии, включая катализ химических реакций, электрокатализ и катализаторы для очистки выбросов автомобильных двигателей.
Определение и роль в химической реакции
Роль катализаторов в химических реакциях невозможно переоценить. Они влияют на скорость протекания реакции и позволяют снизить необходимые условия (температуру, давление), что значительно упрощает процесс и снижает затраты энергии.
Катализаторы могут вознаграждаться при участии в реакции, но при этом они восстанавливаются и могут использоваться снова и снова. Это делает их экономически выгодными и позволяет эффективно использовать их в промышленности и других сферах.
Одна из ключевых особенностей катализаторов заключается в том, что они действуют селективно, то есть способны влиять только на определенные химические реакции или определенные молекулы. Это позволяет контролировать процесс и получать нужные продукты с высокой чистотой.
Катализаторы широко применяются в промышленности, фармакологии, пищевой промышленности и других областях. Они используются для синтеза различных веществ, очистки отходов, снижения выбросов вредных веществ и многих других целей.
| Виды катализаторов | Примеры |
|---|---|
| Гетерогенные | Платина, никель, рутений |
| Гомогенные | Хлорид родия, хлорид палладия |
| Ферменты | Амилазы, протеазы |
Основные принципы работы катализаторов в химических реакциях
Основным принципом работы катализаторов является изменение кинетики реакций. Катализаторы влияют на скорость реакции, снижая энергию активации, необходимую для протекания данной реакции. Благодаря этому, реакция может протекать при более низкой температуре и снижаться расход реактивов.
Одним из принципов работы катализаторов является увеличение поверхности реакции. Катализатор предоставляет активные поверхности, на которых могут происходить химические реакции. Благодаря этому, количество реагентов, соприкасающихся с активными центрами катализатора, увеличивается, что способствует увеличению скорости реакции.
Другим принципом работы катализаторов является изменение энергетических барьеров реакций. Катализаторы могут изменять энергию активации реакции, позволяя ей протекать с меньшим энергетическим затратом. Они могут стабилизировать переходное состояние реакции и ускорять процесс перехода от исходных реагентов к конечным продуктам.
Катализаторы могут быть гетерогенными и гомогенными. Гетерогенные катализаторы находятся в разных фазах с реагентами и продуктами реакции, такие как твердые поверхности или растворы. Гомогенные катализаторы находятся в той же фазе, что и реагенты и продукты.
Катализаторы используются во многих отраслях промышленности, таких как производство пластиков, нефтехимия, фармацевтика и других. Они позволяют повышать эффективность химического процесса, сокращать энергетические затраты и уменьшать вредные выбросы.
Значение катализаторов для промышленности
Катализаторы играют непременную роль в промышленных процессах, ускоряя и повышая эффективность химических реакций. Они способны снижать температуру и давление, необходимые для проведения реакции, что позволяет экономить энергию и ресурсы.
Применение катализаторов позволяет снизить степень загрязнения окружающей среды во время производства. Они способны ограничить количество нежелательных побочных продуктов, образующихся в результате химических реакций. Благодаря этому, применение катализаторов помогает соблюдать экологические нормы и стандарты, а также способствует устойчивому развитию.
В промышленности катализаторы используются во множестве отраслей, включая нефтехимию, пищевую промышленность, производство лекарств и синтеза полимеров. Они способны ускорить реакцию и увеличить выход продукта, что делает их неотъемлемым инструментом массового производства.
Благодаря катализаторам, множество процессов, которые раньше продолжались длительное время или требовали высокой температуры, стали более эффективными и доступными. Катализаторы также обеспечивают большую стабильность и долговечность процессов, что снижает расходы на обслуживание и ремонт оборудования.
Также стоит отметить, что применение катализаторов позволяет создавать новые продукты и материалы, которые ранее были недостижимыми или слишком затратными для производства. Они способствуют развитию инноваций и помогают улучшать качество и свойства материалов, используемых в разнообразных отраслях промышленности.
Виды катализаторов
Катализаторы могут быть различных типов, в зависимости от их состава, формы и способа воздействия на реакцию. Рассмотрим основные виды катализаторов:
- Гетерогенные катализаторы. Это катализаторы, которые находятся в различной фазе с реагирующими веществами. Например, металлы, оксиды и соли, обычно применяемые в промышленности.
- Гомогенные катализаторы. Они находятся в одной фазе с реагирующими веществами. Гомогенные катализаторы обычно являются органическими соединениями, такими как кислоты или основания.
- Ферменты. Это белки, выполняющие роль катализаторов в биологических реакциях.
- Фотокатализаторы. Они используют световую энергию для запуска реакции. Примерами являются фотореакции, которые происходят под воздействием солнечного света.
- Энзимы. Они являются биологическими катализаторами, то есть ферментами, выполняющими специфические функции в организмах.
Катализаторы имеют широкое применение в химической промышленности, фармацевтической и пищевой отраслях, а также в многих других областях. Они позволяют увеличить скорость химических реакций, снизить энергозатраты и повысить выходность продуктов реакции. Благодаря катализаторам, мы можем производить многочисленные продукты, от нефтепродуктов до лекарственных препаратов, эффективно и экономически выгодно.
Гомогенные катализаторы
Гомогенные катализаторы представляют собой растворы, где катализатор находится в одной фазе с реагентами. Они обладают высокой активностью и специфичностью в химических реакциях. Гомогенные катализаторы обычно представляют собой соединения металлов или кислоты, растворенные в органических растворителях.
Применение гомогенных катализаторов наиболее распространено в органическом синтезе, где они способны ускорять реакции при низких температурах и обеспечивать высокую степень контроля над продуктами реакции. Они также широко используются в промышленных процессах для производства различных продуктов, таких как пластмассы, лекарственные препараты, пищевые добавки и другие химические вещества.
Преимуществом гомогенных катализаторов является их высокая эффективность и возможность использования в сложных реакциях, включая реакции с различными функциональными группами. Однако их использование ограничено проблемами, связанными с их отделением от продуктов реакции и обновлением катализатора для последующих циклов.
Примеры гомогенных катализаторов включают ионные металлокомплексы, такие как родий-карбеновые комплексы и платиновые каталитические центры, и органические катализаторы, например, бронстедовские и анионные катализаторы.
| Примеры гомогенных катализаторов | Применение |
|---|---|
| Хлорид родия | Синтез органических соединений |
| Платиновый комплекс | Производство фармацевтических препаратов |
| Карбеновый комплекс | Синтез пластмасс и полимеров |
Гомогенные катализаторы играют важную роль в различных химических реакциях, обеспечивая более эффективные и экологически чистые способы синтеза химических соединений.
Основные характеристики гомогенных катализаторов
Основная характеристика гомогенных катализаторов – их способность контролировать химические реакции путем увеличения скорости реакции без изменения самих катализаторов. Гомогенные катализаторы, как правило, имеют высокую активность и селективность, то есть способность направлять реакцию в определенное направление, образуя определенные продукты.
Одной из ключевых особенностей гомогенных катализаторов является их химическое сходство с реагентами. Это позволяет им взаимодействовать с реагентами и образовывать промежуточные соединения, способствуя ходу реакции. Гомогенные катализаторы также могут регенерироваться после реакции и использоваться вновь.
Важной особенностью гомогенных катализаторов является их растворимость в реакционной среде. Это обеспечивает равномерное распределение катализатора во всем объеме реакционной среды и повышает эффективность реакции. Удобство работы с гомогенными катализаторами состоит в том, что они добавляются прямо в реакционную среду и не требуют дополнительных мер по разделению после реакции.
Гомогенные катализаторы широко применяются в промышленности и лаборатории для проведения различных химических реакций, таких как окисление, гидрогенирование, полимеризация и другие процессы. Из-за своей специфической природы, гомогенные катализаторы позволяют проводить реакции при более мягких условиях и с большей точностью контролировать ход реакции.
Обратите внимание: Текст составлен на основе общих сведений о гомогенных катализаторах и не претендует на полноту описания данного типа катализаторов.
Вопрос-ответ:
Какую роль играют катализаторы в химической реакции?
Катализаторы играют роль, активируя химические реакции, позволяя им проходить при более низких температурах и с более высокой скоростью. Катализаторы не участвуют в самих реакциях и остаются неизменными после окончания реакции.
Каковы различные типы катализаторов?
Существует несколько видов катализаторов. Гетерогенные катализаторы находятся в различных фазах с реагирующими веществами. Гомогенные катализаторы растворены в одной и той же фазе, что и реагирующие вещества. Есть также фотокатализаторы, которые возбуждаются светом и стимулируют химические реакции.
Какие примеры катализаторов можно привести?
Примеры катализаторов включают металлы, такие как платина, никель и железо. Они часто используются в промышленности для синтеза важных химических соединений. Также существуют биологические катализаторы, такие как ферменты, которые участвуют в химических реакциях в живых организмах.
Какие преимущества использования катализаторов в химических реакциях?
Использование катализаторов имеет несколько преимуществ. Во-первых, они позволяют снизить температуру и давление реакции, что экономит энергию и снижает затраты на производство. Во-вторых, они повышают скорость реакции, что увеличивает производительность. Кроме того, катализаторы уменьшают образование побочных продуктов и могут быть использованы многократно.
В каких областях и промышленности применяются катализаторы?
Катализаторы широко применяются в промышленности. Они используются в процессах производства пластмасс, лекарств, удобрений, синтеза полимеров, очистки газовых выбросов и многих других. Катализаторы также используются в нефтяной и газовой промышленности для обработки сырой нефти и углеводородных газов.
Что такое катализаторы и как они работают?
Катализаторы — это вещества, которые позволяют увеличить скорость химических реакций, не участвуя в самих реакциях. Они обычно снижают энергию активации реакции, облегчая прохождение химической реакции через переходное состояние. Это достигается благодаря высокой активности поверхности катализатора, которая позволяет молекулам реакционных веществ взаимодействовать более эффективно.