В химии водородная связь — это тип взаимодействия между молекулами, в котором водородный атом, связанный с более электроотрицательным атомом, привлекает электроны от другого атома. Такое взаимодействие приводит к образованию слабой прямой связи между молекулами. Водородная связь обладает рядом уникальных свойств, которые делают ее одной из самых сильных интермолекулярных связей в химии.
Водородные связи встречаются во многих химических соединениях, включая воду, спирты, карбоновые кислоты и белки. Они являются важными для структуры и свойств этих веществ. Например, водородные связи определяют особенности свойств воды, такие как поверхностное натяжение и высокая теплота парообразования. Водородные связи также играют важную роль в стабилизации вторичной структуры белков, таких как спираль альфа и бета-листы.
Водородные связи легко образуются и разрушаются. Они могут образовываться между атомами водорода и электроотрицательными атомами, такими как кислород, азот и фтор. Водородный атом обладает положительным зарядом, а атомы как кислорода или азота — отрицательным зарядом, что обеспечивает притяжение между ними. Кроме того, водородные связи обеспечивают уникальные свойства веществ, которые они формируют.
Виды химических связей в молекулах
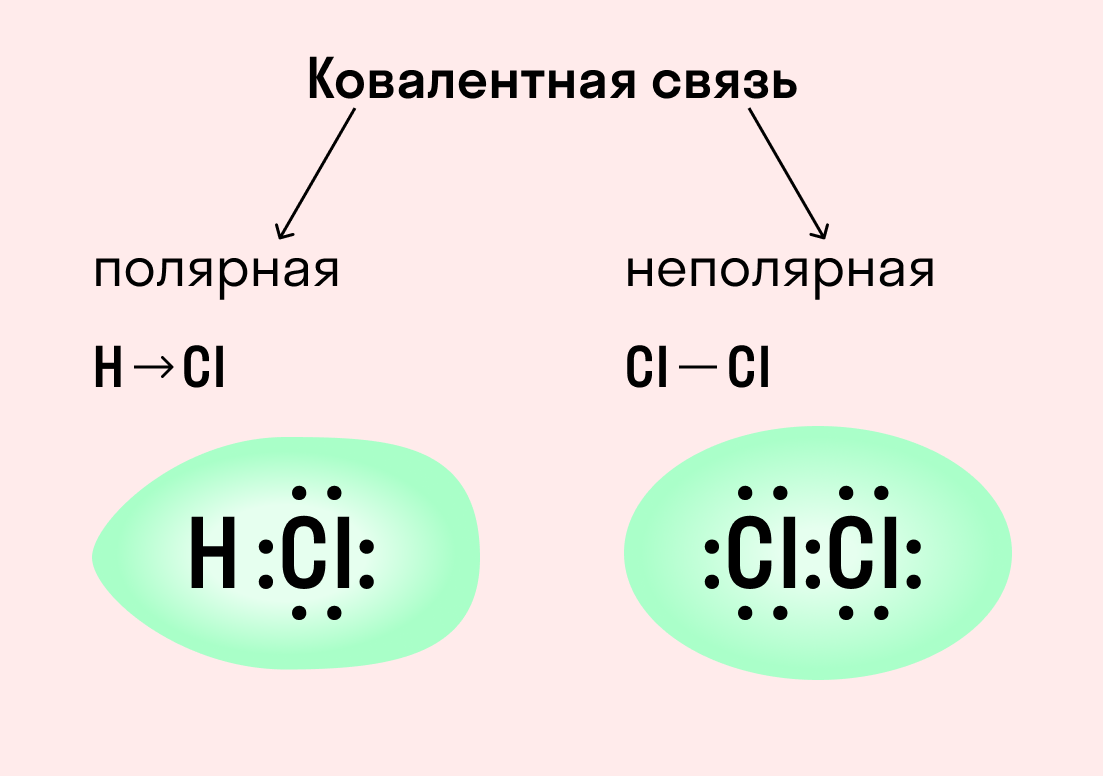
1. Ковалентную связь: Эта связь образуется, когда два атома делят одну или несколько пар электронов. В ковалентной связи электроны общий для обоих атомов и разделяются между ними. Ковалентная связь является самой сильной разновидностью химической связи и наиболее распространена в органических молекулах.
2. Ионическую связь: В ионической связи электроны полностью передаются от одного атома к другому, что приводит к образованию ионов с противоположным зарядом. Ионы притягиваются друг к другу силой электростатического взаимодействия, образуя ионную связь. Эта связь обычно возникает между металлами и неметаллами.
3. Металлическую связь: В металлической связи каждый атом металла делит свои электроны с другими атомами в металле. В результате образуется электронное облако, которое окружает положительно заряженные атомы металла. Металлическая связь является типичной для металлов и обуславливает особые свойства металлических материалов, таких как электропроводность и пластичность.
4. Водородную связь: Водородная связь формируется, когда водородный атом связан с электроотрицательным атомом (например, кислород, азот или фтор). Электроотрицательный атом притягивает электроны водородного атома, создавая положительный и отрицательный полюса в молекуле. Водородная связь слабее ковалентной связи, но все же играет важную роль во многих биологических и химических процессах.
5. Ван-дер-ваальсову связь: Ван-дер-ваальсова связь происходит между нейтральными молекулами или атомами. Она обусловлена временным изменением взаимного расположения электронов в молекулах или атомах, создавая моментальное электростатическое притяжение между ними. Ван-дер-ваальсовы связи являются самыми слабыми видами химических связей, но они играют важную роль в многочисленных физических и химических процессах.
У каждой химической связи есть свои уникальные свойства и влияние на физические и химические свойства вещества. Изучение разных видов химических связей помогает понять многообразие структур и свойств молекул.
Водородная связь: что это такое?
Водородная связь обладает большой силой, но она является слабее, чем ковалентная или ионная связь. Ее сила зависит от расстояния между атомами и угловой ориентации. Обычно водородная связь образуется между атомами водорода и атомами кислорода, азота или фтора.
Водородная связь играет роль во многих важных биологических процессах, таких как сворачивание белков, формирование двойной спиральной структуры ДНК, а также взаимодействия между различными молекулами в клетке. Она также является ключевым фактором в свойствах воды, таких как поверхностное натяжение, высокая теплота парогенерации и уникальная плотность в жидком состоянии.
Примеры водородной связи:
Один из известных примеров водородной связи — это связь между двумя молекулами воды. В каждой молекуле воды имеются два атома водорода, каждый из которых образует водородную связь с атомом кислорода другой молекулы. Это позволяет молекулам воды образовывать структуру сети, которая обладает высокой устойчивостью и способствует многим физическим свойствам воды.
Значение водородной связи:
Водородная связь имеет огромное значение для многих областей науки, включая биологию, химию и физику. Понимание водородной связи помогает ученым лучше понять молекулярные структуры, химические реакции и взаимодействия между молекулами. Это знание позволяет разрабатывать новые лекарственные препараты, материалы с определенными свойствами и улучшать процессы в области энергетики и окружающей среды.
Таким образом, водородная связь является важным и интересным аспектом химии, который играет важную роль в мире науки и технологий.
Как работает водородная связь?
Водородная связь имеет несколько особенностей, которые делают ее так важной. Во-первых, она является слабой связью, что означает, что ее энергия связи намного меньше, чем у ковалентной связи. Это позволяет водородной связи легко образовываться и разрушаться, что особенно полезно для биологических систем, где небольшие изменения в структуре могут иметь большое значение.
Во-вторых, водородная связь обладает направленностью. Это означает, что она может формироваться только в определенной геометрии, где электроотрицательный атом и водородный атом находятся на определенном расстоянии друг от друга и образуют прямой угол. Эта направленность и точная геометрия водородной связи позволяют ей быть основой многих биологических структур и функций, таких как спиральная структура ДНК и взаимодействие протеинов.
Водородная связь также играет важную роль в межмолекулярных взаимодействиях. Она позволяет воде образовывать сеть водородных связей, которая обеспечивает ей высокую поверхностное натяжение, и способствует образованию кристаллических структур, таких как снег и лед.
В итоге, водородная связь является ключевым феноменом в химии и биологии, который имеет широкий спектр применений и играет важную роль во многих естественных явлениях.
Формирование водородной связи
Формирование водородной связи происходит из-за разности в электроотрицательности атомов. Кислород, азот и фтор являются сильными электроотрицательными элементами, в то время как водород является слабым электроотрицательным элементом.
Когда между атомами водорода и электроотрицательным атомом образуется водородная связь, электроотрицательный атом притягивает электроны, которые несет атом водорода. В результате образуется положительно заряженный водород и отрицательно заряженный электроотрицательный атом.
Водородная связь обладает большой прочностью и является одной из ключевых сил, определяющих свойства веществ. Она играет важную роль во многих биологических и химических процессах, таких как образование двухспиральной структуры ДНК или образование водородных мостиков между молекулами воды.
Формирование водородной связи способствует созданию стабильной структуры вещества и его физических и химических свойств. Это взаимодействие играет важную роль в самых разных областях химии и является ключевым фактором в понимании многих химических процессов.
Свойства водородной связи
| Свойство | Описание |
|---|---|
| Слабость | Водородная связь является слабой по сравнению с ковалентной и ионной связью. Это позволяет ей динамически образовываться и разрываться в зависимости от окружающих условий. |
| Длина и угол | Водородная связь обычно имеет длину в диапазоне от 1.5 до 2.5 ангстрем и угол в диапазоне от 130 до 180 градусов. Это обеспечивает оптимальную стабильность и форму молекул. |
| Дипольность | Водородная связь возникает между атомами, которые имеют различные электроотрицательности. В результате образуется дипольный момент, который обусловливает силу притяжения между молекулами. |
| Влияние на свойства вещества | Водородная связь может оказывать значительное влияние на свойства веществ, такие как точка кипения, плотность, вязкость и т.д. Это связано с формированием и разрушением водородных связей при изменении условий окружающей среды. |
Свойства водородной связи делают ее уникальной и важной для понимания многих физических и химических процессов. Изучение этой связи позволяет раскрыть механизмы многих биологических систем и применить их в различных областях науки и технологий.
Примеры водородной связи в природе
Примеры водородной связи:
- Молекула воды (H2O) — водородные связи между атомами водорода и атомом кислорода делают молекулу воды устойчивой и обеспечивают ее высокую кипящую точку.
- Белки — водородные связи играют важную роль в структуре белковых молекул, обеспечивая их трехмерную конформацию и стабильность.
- Нуклеиновые кислоты (ДНК и РНК) — водородные связи между щелочными основаниями, составляющими структуру нуклеиновых кислот, обеспечивают правильное спаривание оснований, что позволяет хранить и передавать генетическую информацию.
- Целлюлоза — водородные связи между полимерными цепочками целлюлозы придают ей прочность и стабильность.
- Льды — водородные связи в ледяных кристаллах образуют устойчивые структуры и обеспечивают им характерные физические свойства, такие как плавление и кристаллизация при определенных условиях.
Примеры водородной связи в природе прекрасно иллюстрируют важность этого феномена и его роль в создании и поддержании структур и свойств различных веществ.
Полнота водородной связи
Водородная связь обычно возникает между атомами водорода и атомами других элементов, например кислорода, азота или фтора. Водородные связи сильные и важны для многих биологических и химических процессов, таких как структура белков и ДНК.
Примеры полной водородной связи:
1. В молекуле воды, каждый атом водорода связан с атомом кислорода через полную водородную связь.
2. Вторичная структура ДНК, называется двухцепочечной спиралью, образуется благодаря полным водородным связям между азотистыми основаниями.
Важно отметить, что полная водородная связь является энергетически выгодной, и это помогает определенным молекулам и структурам сохранять свою стабильность и функциональность.
Значение водородной связи в жизни организмов
Водородная связь в жизни организмов присутствует на разных уровнях организации – от молекулярных структур до биологических систем. Она играет ключевую роль во многих биологических процессах и функциях.
Структура ДНК и РНК
Водородные связи играют особую роль в структуре и функции ДНК (дезоксирибонуклеиновой кислоты) и РНК (рибонуклеиновой кислоты). В ДНК водородные связи образуют две комплиментарные цепи, связывая между собой основания азотистых оснований – аденина (A) со тимином (T) и гуанина (G) с цитозином (C). Благодаря формированию водородных связей между основаниями, ДНК может быть точно скопирована и передана из поколения в поколение.
Структура белков

Водородные связи также играют важную роль в структуре белков. Они способствуют формированию третичной и четвертичной структур белков – пространственного складывания аминокислотных цепей. Водородные связи между боковыми группами аминокислот позволяют формировать устойчивые пространственные структуры белков и определяют их функцию.
В целом, водородная связь является важным фактором в стабилизации молекулярных структур биологических макромолекул (например, ДНК, РНК и белков) и обеспечивает правильное функционирование организмов. Изучение и понимание водородной связи в жизни организмов имеет большое значение для медицины, фармакологии, биотехнологии и других научных областей.
Применение водородной связи в науке и технологиях
Водородная связь, или химическая связь водородной, играет важную роль во многих областях науки и технологий. Ее особенности и уникальные свойства позволяют использовать ее для различных целей и достижений.
Одним из применений водородной связи является ее использование в биологии и медицине. Водородная связь играет ключевую роль в формировании структуры и функции биологических молекул, таких как ДНК и белки. Изучение взаимодействия молекул через водородные связи позволяет понять механизмы работы многих биологических систем, а также помогает разрабатывать новые лекарственные препараты и методы лечения различных заболеваний.
Водородная связь также активно применяется в химии и материаловедении. Она используется для создания новых материалов с уникальными свойствами. Например, водородные связи помогают создавать пластические и эластичные полимеры, а также материалы с пониженной температурой плавления, что позволяет их использовать в различных сферах, включая электронику, строительство, авиацию и промышленность в целом.
Также водородная связь находит применение в кристаллографии. Она помогает в определении структуры и свойств кристаллов, исследовании их физических и химических свойств, а также разработке новых кристаллических материалов с улучшенными характеристиками.
Наконец, водородная связь играет роль в каталитических процессах. Многие реакции в химии и промышленности требуют катализаторов, и водородные связи могут быть использованы для улучшения эффективности и скорости данных реакций.
В итоге, водородная связь является одним из фундаментальных понятий в химии и науке в целом. Ее использование в различных областях науки и технологий помогает расширить наши знания о природе и улучшить нашу жизнь в целом.
Вопрос-ответ:
Какую химическую связь называют водородной?
Водородная связь — это слабая электростатическая связь между атомами водорода и электроотрицательными атомами (как правило, кислородом, азотом или фтором) в молекулах различных веществ.
Какую роль играет водородная связь в биологии?
Водородная связь играет важную роль во многих биохимических процессах. Например, она участвует в структуре двухспиральной ДНК и в формировании третичной структуры белков. Она также влияет на свойства воды, обеспечивая ей высокую плотность, способность образовывать гидраты и теплоемкость.
Как можно ослабить водородную связь?
Водородные связи можно ослабить, например, путем повышения температуры или понижения давления. Также влияние на водородную связь может оказывать растворитель, изменяя полярность среды.
Какие вещества образуют водородные связи?
Водородные связи могут образовываться между атомами водорода и электроотрицательными атомами какого-либо другого элемента. Некоторые примеры веществ, образующих водородные связи, включают воду, спирты, аммиак, карбонаты и белки.