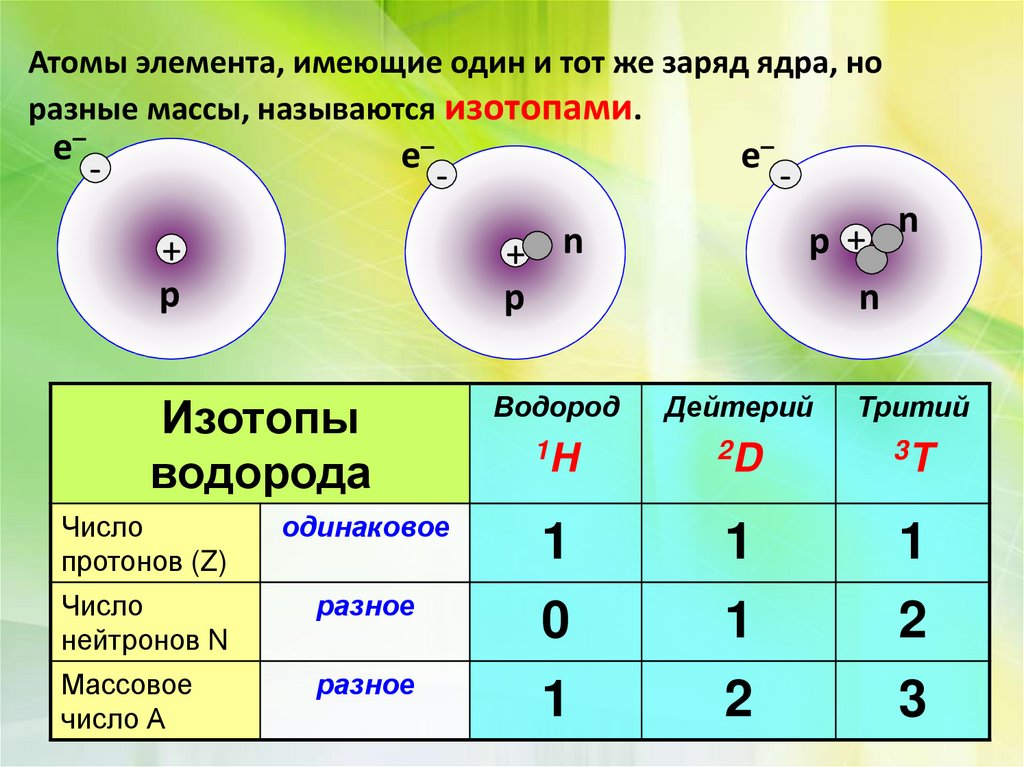
Изотопы являются разновидностью атомов одного и того же элемента, отличающаяся только числом нейтронов в их ядре. При этом число протонов в ядре остается неизменным и определяет химические свойства данного элемента. Изотопы обладают схожими химическими свойствами, но некоторые из них имеют дополнительные физические или ядерные свойства, которые делают их интересными для научных исследований.
Одним из самых известных примеров изотопов является гидроген. У этого элемента существуют три изотопа: обычный водород (1H) с 1 протоном и без нейтронов в ядре, дейтерий (2H) с 1 протоном и 1 нейтроном, и тритий (3H) с 1 протоном и 2 нейтронами. Несмотря на то, что все три изотопа гидрогена являются химически равноправными и практически идентичными, тритий обладает радиоактивными свойствами и широко используется в научных исследованиях и в промышленности.
Изотопы могут также быть полезными для контроля ядерных реакций и для определения возраста археологических и геологических образцов. Измерение относительного содержания изотопов в образцах и анализ их распределения позволяют определить исторические и геологические процессы, происходившие на Земле в течение миллионов лет. Таким образом, изотопы являются удивительным и мощным инструментом для изучения микромира и процессов, происходящих в нем.
Ядра атомов
Ядро атома состоит из протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Ядра атомов с одинаковым числом протонов и разным числом нейтронов называются изотопами.
Изотопы
Ядра атомов одного и того же элемента могут иметь различное количество нейтронов. Это ведет к появлению изотопов. Изотопы отличаются друг от друга только числом нейтронов в ядре, что влияет на их стабильность и свойства.
Изотопы обозначаются с помощью специальной нотации, где перед именем химического элемента указывается число нуклонов (протонов и нейтронов) в ядре. Например, для водорода с одним протоном и двумя нейтронами, его изотоп будет обозначаться как водород-3 (или дейтерий).
Таблица изотопов
| Элемент | Протоны | Нейтроны | Изотоп |
|---|---|---|---|
| Углерод | 6 | 6 | Углерод-12 |
| Углерод | 6 | 7 | Углерод-13 |
| Углерод | 6 | 8 | Углерод-14 |
Таким образом, ядра атомов могут иметь одинаковое число протонов и разное число нейтронов, что делает изотопы уникальными вариантами элементов.
Ядра атомов с одинаковым числом протонов и разным числом нейтронов
Ядра атомов состоят из протонов и нейтронов. Протоны имеют положительный электрический заряд, а нейтроны не имеют заряда. Число протонов в ядре определяет его химические свойства и определяет элемент.
Однако у ядер одного и того же элемента может быть разное число нейтронов. Такие ядра называются ядрами с одинаковым числом протонов и разным числом нейтронов.
Различие в числе нейтронов в ядрах одного элемента обусловлено разными изотопами этого элемента. Изотопы имеют одинаковое количество протонов, а значит, и одинаковое химическое свойство, но различаются по массе и, следовательно, по стабильности. Изотопы могут быть радиоактивными или стабильными.
Ядра атомов с одинаковым числом протонов и разным числом нейтронов играют важную роль в науке и промышленности. Изотопы используются в радиоактивной терапии, в процессе радиоуглеродного датирования и для многих других целей.
Названия для ядер атомов
Ядра атомов, имеющих одинаковое число протонов, но разное число нейтронов, называются изотопами. Названия для ядер атомов формируются путем указания общего атомного номера и массового числа.
Общий атомный номер ядра атома представляет собой число протонов в его ядре. Массовое число ядра атома является суммой числа протонов и числа нейтронов.
Для названия изотопа используется общепринятая схема записи: атомный номер в левом верхнем углу ядра и массовое число в левом нижнем углу ядра. Удобно использовать символы элементов периодической системы для обозначения атомного номера и специальные обозначения для массового числа.
Например, для изотопа углерода с атомным номером 6 и массовым числом 14 названия будет записываться как 14C или С-14.
| Ядро атома | Название |
|---|---|
| 1H | Водород-1 |
| 6C | Углерод-12 |
| 7N | Азот-14 |
 | Кислород-16 |
| 20Ca | Кальций-40 |
Таким образом, названия для ядер атомов позволяют однозначно идентифицировать изотопы и сравнивать их свойства в различных физических и химических процессах.
Свойства ядер атомов
Ядра атомов имеют ряд характеристик, которые определяют их поведение и свойства. Основные свойства ядер атомов включают следующие:
1. Массовое число (А)
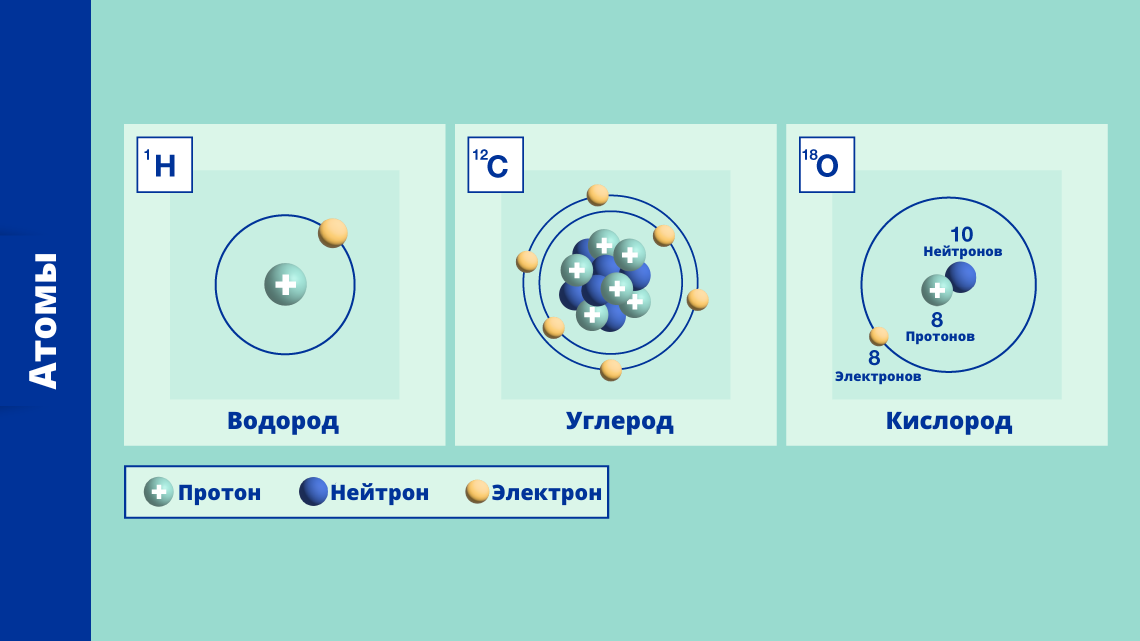
Массовое число ядра определяется как сумма числа протонов и числа нейтронов в нем. Оно обозначается буквой A.
2. Заряд ядра (Z)
Заряд ядра определяется числом протонов в нем и обозначается буквой Z. Заряд ядра является положительным и определяет его химические свойства и взаимодействие с другими частицами.
Ядра атомов с одинаковым числом протонов, но разным числом нейтронов, называются изотопами. Изотопы одного и того же элемента могут иметь разные химические свойства и энергетическую устойчивость.
Взаимодействие между ядрами атомов происходит через такие явления, как ядерный синтез, деление и радиоактивный распад. Эти процессы играют важную роль в ядерной физике и имеют множество практических применений в различных областях, таких как энергетика, медицина и наука.
| Свойство | Описание |
|---|---|
| Массовое число (А) | Сумма числа протонов и числа нейтронов в ядре |
| Заряд ядра (Z) | Число протонов в ядре |
| Изотопы | Ядра атомов с одинаковым числом протонов, но разным числом нейтронов |
Взаимодействие ядер атомов
Ядра атомов могут взаимодействовать друг с другом, образуя различные ядерные реакции. В основном, такие реакции происходят при столкновениях ядер с достаточно большой энергией.
Ядерные силы
Взаимодействие ядер обусловлено ядерными силами, которые являются одними из сильнейших сил в природе. Ядерные силы действуют между нуклонами — протонами и нейтронами, находящимися внутри ядра.
Ядерные силы обладают ближним и дальним действием. Ближнее действие сил проявляется на очень коротких расстояниях (до 2-3 ферми), а дальнее действие — на больших расстояниях (до нескольких десятков ферми).
Типы ядерных реакций
Существует несколько типов ядерных реакций, которые могут происходить при взаимодействии ядер атомов. Вот некоторые из них:
Ядерный распад
Ядерный распад — это процесс, при котором ядро атома превращается в другое ядро, выбрасывая при этом один или несколько частиц. Существуют различные виды ядерного распада, такие как альфа-распад, бета-распад и гамма-распад.
Ядерный синтез
Ядерный синтез — это процесс, при котором два или более ядерных частиц объединяются, образуя новое ядро. Ядерный синтез происходит в звездах, где высокие температуры и давления позволяют преодолеть электростатические отталкивающие силы между ядерными частицами.
Ядерное деление
Ядерное деление — это процесс, при котором ядро атома расщепляется на два или более меньших ядра. Ядерное деление является основой работы атомной энергетики и использования ядерного оружия.
Взаимодействие ядер атомов может быть очень разнообразным и носить как спонтанный, так и вызванный внешним воздействием характер. Изучение ядерных реакций имеет большое значение для физики ядра и применяется в различных областях науки и техники.
Экспериментальные методы изучения ядер
Одним из таких методов является ионизационная спектроскопия. С помощью этого метода можно измерить энергию излучения, испускаемого атомными ядрами. Изучая полученные спектры, ученые могут определить состояние и структуру ядра.
Еще одним методом изучения ядер является ядерная масс-спектроскопия. Этот метод основан на измерении массы ядер с помощью масс-спектрометра. Полученные данные позволяют ученым выявлять закономерности в ядерной структуре и различия между ядрами с одинаковыми числами протонов и разными числами нейтронов.
Для изучения взаимодействия ядер применяется метод ядерной спектроскопии. С его помощью исследуются спектры фотонов, испускаемых ядрами при столкновении с другими ядрами или частицами. Анализ этих спектров помогает ученым понять особенности взаимодействия и внутреннюю структуру ядер.
Также существует метод ядерной фрагментации, который позволяет раздробить ядра, сталкивающиеся с другими высокоэнергичными частицами. Исследуя фрагменты разрушенных ядер, исследователи выявляют особенности и свойства ядерной материи.
Все эти экспериментальные методы позволяют нам расширить наши знания о ядрах атомов и лучше понять фундаментальные законы природы.
Применение ядерных явлений
Ядерная энергетика
Одним из основных применений ядерных явлений является производство электроэнергии. Оно основано на явлении ядерного деления, при котором ядро делится на две или более частицы, при этом выделяется энергия. Энергия, выделяющаяся при ядерном делении, используется для нагревания воды, которая превращается в пар и запускает турбину, приводящую в действие генератор электроэнергии.
Ядерная медицина
Ядерные явления играют важную роль в медицине. Одним из примеров применения ядерных технологий является радиоизотопная диагностика. Пациенту вводится радиоактивный препарат, который позволяет врачам получить детальные изображения внутренних органов. Это позволяет рано выявлять заболевания и улучшить качество медицинской помощи.
| Применение | Описание |
|---|---|
| Производство изотопов | Ядерные реакторы позволяют получать важные для науки и медицины изотопы, которые используются для проведения исследований и лечения некоторых заболеваний. |
| Радиотерапия | Использование ядерных излучений для лечения определенных видов рака. Радиотерапия может быть использована для уничтожения опухоли или снижения ее размеров. |
| Радиоизотопная терапия | Использование радиоактивных изотопов для лечения определенных заболеваний, таких как гипертиреоз или болезнь Шлейтера. |
Применение ядерных явлений имеет огромный потенциал в различных областях науки и техники, и исследования в этой области продолжаются для нахождения новых способов использования ядерной энергии.
Опасность ядерных реакций
Распространение радиоактивности
Одним из наиболее опасных последствий ядерных реакций является распространение радиоактивности. При ядерном распаде стабильные ядра превращаются в нестабильные, высвобождая радиоактивное излучение. Это излучение может нанести вред здоровью людей и окружающей среде.
Возможное разрушение
Ядерные реакции могут привести к разрушению физических объектов и инфраструктуры. Взрыв ядерного устройства может вызвать огненные шары, выброс радиоактивных продуктов, радиационные ожоги и разрушение зданий. Это может иметь серьезные последствия для жизни людей и экологии.
В связи с этим, ядерные реакции требуют особого внимания и контроля со стороны научных исследований, государств и международных организаций. Безопасность и предотвращение ядерных аварий являются приоритетными задачами современного мира.
Вопрос-ответ:
1. Что такое ядра атомов с одинаковым числом протонов и разным числом нейтронов?
Ядра атомов с одинаковым числом протонов и разным числом нейтронов называются изотопами.
2. Как называются ядра атомов с одинаковым числом протонов и разным числом нейтронов?
Ядра атомов с одинаковым числом протонов и разным числом нейтронов называются изотопами.
3. Какой термин используется для обозначения ядер атомов с одинаковым числом протонов и разным числом нейтронов?
Для обозначения ядер атомов с одинаковым числом протонов и разным числом нейтронов используется термин «изотопы».
4. Чем отличаются ядра атомов с одинаковым числом протонов и разным числом нейтронов?
Ядра атомов с одинаковым числом протонов и разным числом нейтронов отличаются числом нейтронов, что приводит к различной массе и стабильности изотопов.
5. Каково название для ядер атомов с одинаковым числом протонов и разным числом нейтронов?
Ядра атомов с одинаковым числом протонов и разным числом нейтронов называются изотопами.
Как называются ядра атомов с одинаковым числом протонов и разным числом нейтронов?
Ядра атомов с одинаковым числом протонов и разным числом нейтронов называются изотопами.
Что такое изотопы?
Изотопы — это ядра атомов, содержащие одинаковое количество протонов, но разное количество нейтронов. Они имеют одинаковый химический состав, но различаются по массовому числу. Поэтому изотопы одного и того же элемента имеют разную атомную массу.